오피니언
도래할 액체생검 전성시대, 선점나선 해외 기업들
바이오스펙테이터 조정민 기자
[액체생검 시대의 도래②]‘FDA 최초승인’ 로슈, ‘임상결과 발표’ 지노믹헬스·바이오셉트·트로바진
미국 염기서열분석 장비 대표기업인 일루미나에서 스핀오프(Spin off)한 그레일(Grail)은 이달 초 9억달러(1조 100억원)를 투자받아 업계를 놀라게 했다. 차세대 염기서열 분석 기술(NGS, Next generation sequencing)을 이용해 암을 조기진단하는 액체생검 시장 진출 계획에 투자자들이 과감히 배팅했다.
암 진단에 주로 사용된 조직생검과 영상학적 진단기법이 가진 단점을 보완하는 액체생검이 각광받게 되면서 많은 기업들이 시장을 선점하기 위해 진단제품 개발에 박차를 가하고 있다. 그레일은 시작단계지만 로슈, 지노믹헬스, 바이오셉트, 트로바진 등은 이미 허가를 받았거나 기술이 완성단계에 이르렀다.
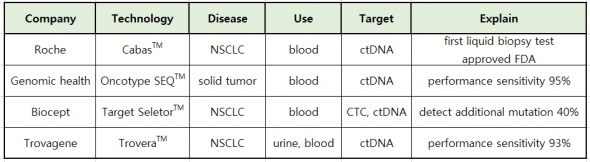
▲각 기업의 액체생검 진단기술 비교.
◇로슈(Roche)의 ‘Cobas EGFR Mutation Test v2’
지난해 6월, 로슈분자시스템(Roche molecular system)이 개발한 ‘Cobas EGFR Mutation test v2(Cobas)’가 비소세포폐암 치료제인 타세바(Tarceva)의 동반진단기기로 FDA 승인을 받았다. 이는 액체생검 기반의 진단으로는 최초의 승인이다.
유전자변이의 형태는 여러가지가 존재한다. 유전자를 구성하는 4개의 염기인 아데닌(Adenin), 티민(Thymine), 구아닌(Guanine), 사이토신(Cytosine)의 배열순서가 치환되면서 나타나는 치환변이와 일부의 유전자 결실 혹은 삽입으로 인해 발생하는 변이 등이 있다.
Cobas는 EGFR 유전자 Exon18의 G719X 치환 변이, Exon19의 결실 변이, Exon20의 T790M, S768I의 치환 혹인 삽입변이, Exon21의 L858R, L861Q의 치환변이 등을 포함한 총 42개의 변이를 검출할 수 있다. 각 돌연변이 표현형에 맞게 디자인된 프라이머(primer)를 이용한 실시간 중합효소 연쇄반응(Real-time PCR)을 통해 표적 유전물질을 증폭, 검출한다.
▲로슈(Roche)의 Cobas EGFR mutation test v2.
로슈분자시스템은 이미 FDA로부터 조직생검을 통해 채취한 종양조직에서 얻은 유전자 샘플에서 변이를 확인하는 EGFR mutation kit를 승인을 받은 상태였다. 따라서 액체생검 기반의 Cobas 진단키트가 기존의 진단기기와 동일한 결과를 도출하는지 확인하기 위해 다중심 임상연구를 디자인하고 비소세포폐암 환자들 대상의 임상3상을 진행했다.
그 결과, 조직 샘플에서 발견된 Exon19의 결실과 L858R의 변이 등이 플라즈마를 이용한 진단에서도 모두 검출됐다. 조직에서 양성으로 판명이 난 경우, 76.7%의 일치율로 플라즈마 샘플에서도 양성이 나타났으며, 조직에서 음성인 경우에는 무려 98.2%의 검사 일치율을 보였다. FDA는 이 임상결과를 토대로 Cobas EGFR Mutation test v2를 체액 샘플을 이용한 동반진단기기로 최초 승인했다.
회사 측은 FDA 허가 당시 "질병이 진행된 환자들 가운데 조직으로부터 변이된 유전자 정보를 얻지 못한 경우, 정확한 치료제 선택에 어려움이 있었는데 Cobas의 FDA 승인으로 인해 환자에게 더 나은 기회를 제공하는 근거가 되는 분자적 시험과 관련된 장벽을 완화할 수 있게 됐다"고 소개했다.
◇ 지노믹헬스(Genomic health)의 ‘Oncotype SEQ Liquid Select’

▲지노믹헬스(Genomic health)의 Oncotype SEQ.
지노믹헬스는 지난해 덴마크에서 열린 2016 ESMO에서 자사가 개발한 액체생검 기반의 돌연변이 검출 패널 'Oncotype SEQ Liquid biopsy'의 유효성을 확인한 실험 결과를 처음 발표했다.
Oncotype SEQ는 NGS를 이용해서 환자의 혈액 속에 존재하는 순환종양DNA를 검출, 분석하는 것으로 악성종양의 변화와 치료에 관한 반응, 내성과 관련된 4가지 형태의 유전자 변이를 확인할 수 있다.
17개의 선별된 유전자로 구성된 Oncotype SEQ는 4기의 고형암 환자의 치료에 직접적으로 사용가능한 임상-실용적인 결과를 도출하도록 디자인 됐으며, 유효성 실험 역시 NCCN의 가이드라인에 포함되거나 FDA 승인을 받은 치료제에 대한 감수성 또는 내성과 관련된 유전적 마커 확인에 초점을 맞춰 진행했다.
진단의 유효성을 확인하는 실험에서 Oncotype SEQ는 샘플당 99%의 특이성을 보였으며 민감도 역시 95%의 결과를 나타냈다. 또한 혈액 속에 존재하는 전체 DNA(cell free DNA)의 0.19~0.56%로 존재하는 종양유전자를 검출할 수 있었다. 같은 샘플을 사용해서 여러번 실험함으로써 재현성을 확인한 결과에서도 95%의 재현율을 보였다.
당시 지노믹헬스 측은 Oncotype SEQ에 대한 근거가 되는 추가 데이터를 축적하기 위해 미국과 아시아, 유럽 등지의 25곳에서 국제적, 다중심 임상연구를 진행할 계획이라고 밝혔다.
◇바이오셉트(biocept)의 ‘Target Selector assay’
바이오셉트는 2014년 상장한 기업으로 액체생검 기술 개발에 주력하고 있다. 이들이 개발한 ‘Target Selector assay’는 액체생검에서 바이오 마커로 사용되는 순환종양세포(circulating tumor cell; CTC)와 순환종양DNA(circulating tumor DNA; ctDNA) 두 종류의 분석이 가능한 ‘듀얼 플랫폼’ 기술이며 이를 통해 임상에서 유용한 암 바이오마커 활용에 초점을 맞춰 개발 및 실험을 진행하고 있다.
바이오셉트 역시 2016 ESMO에서 비소세포폐암 환자 대상으로 진행한 자사의 액체생검 기술 유효성을 확인한 임상시험 결과를 발표했다. 신규 확진 환자와 EGFR TKI (Tyrosine kinase inhibitor) 치료제 내성 환자로 구성된 60명의 비소세포폐암 환자를 대상으로 EGFR의 변이를 검출하기 위해 체액을 이용한 유전형질분석을 시행했다.
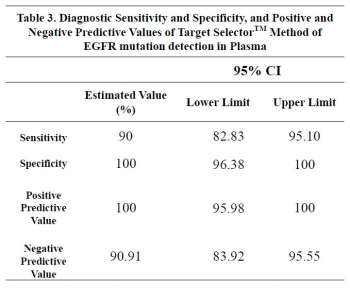
▲바이오셉트(Biocept)의 Tatget Selector 성능. (출처: 2016 ESMO poster 'Clinical evalluation of the utility of a liquid biopsy to determine the mutational profile in advanced NSCLC patients')
조직샘플을 이용한 검사 결과와 비교했을 때 EGFR, KRAS, ALK의 변이에 관해 90% 가량의 일치율을 보인다는 것을 확인했으며 EGFR 변이가 일어난 환자 중 28%가 KRAS 변이를 동시에 나타냈고 KRAS 변이 양성 환자 중 75%에서 BRAF 변이가 관찰됐다고 설명했다. 또한 다중변이가 일어난 환자의 40%가 조직생검을 통해서 발견하지 못한 1개 이상의 추가 변이를 발견했다.
바이오셉트는 이러한 결과를 바탕으로 자사의 Target Selector assay가 EGFR, KRAS, BRAF 변이를 빠르게 검출할 수 있으며 조직 샘플을 이용한 유전형질분석보다 더 높은 민감도를 가진다고 밝혔다. 회사 측은 ‘Target Selector assay’가 TKI 치료제를 사용하는 환자들의 치료효과와 내성에 대한 지속적인 모니터링 용도로 사용될 가능성에 대해 높은 기대를 보이고 있다.
◇트로바진(Trovagene)의 ‘Trovera urine-blood based liquid biopsy’
트로바진은 소변과 혈액에 존재하는 순환종양DNA를 사용해서 EGFR, KRAS, BRAF 등의 유전자 변이와 치료 또는 치료과정, 치료 후에 암의 변화를 모니터링할 수 있는 정밀 암 모니터링 플랫폼 기술 (Precision Cancer Monitoring)인 “Trovera urine and blood based liquid biopsy(Trovera)”를 구축했다.
이들은 EGFR 유전자의 변화 가운데서도 T790M 변이에 주목했다. 아파티닙(afatinib), 제피티닙(gefitinib)과 같은 EGFR-TKI 치료제를 적용한 이후 약제 내성(Drug resistance)이 발생한 비소세포폐암 환자 중 60%에서 T790M 변이가 발견된다는 사실이 밝혀졌기 때문이다. 2015년 11월 FDA는 오시머티닙(osimertinib)을 T790M 변이가 발생해 치료제 내성이 생긴 환자들에게 적용하는 것을 허가했으며 이외에도 많은 후보약물이 준비되고 있다.
트로바진은 Trovera 기술을 적용해 폐암환자의 혈액과 소변에서 EGFR T790M 변이를 검출하고 그 결과가 조직생검을 통해 얻은 샘플의 결과와 일치하는지 확인하는 임상시험을 진행했다. 이 임상연구결과는 암 연구분야의 유명 국제 학술지에 게재됐으며 지난해 열린 ‘2016 ASCO’에서 발표하기도 했다.
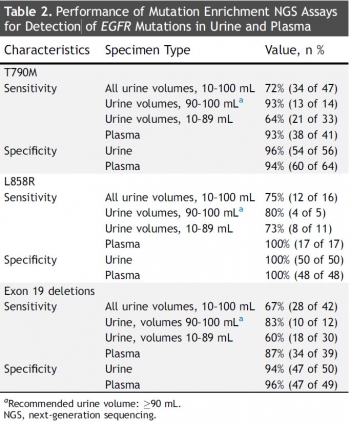
▲트로바진(Trovagene)의 Trovera 성능.(출처: A highly sensitive and quantitative test platform for detection of NSCLC EGFR mutations in urine and plasma, Journal of Thoracic Oncology)
임상시험 대상자는 총 63명이었고, 그 중 60명이 조직생검을 통해 EGFR 변이 검출 검사를 받았다. 조직 샘플을 통한 검사 결과, T790M 변이의 경우 72%, L858R 변이 75%, Exon19의 결실은 67%의 검출율을 나타냈다.
반면 90~100ml의 소변에서 ‘Trovera’기술을 이용해 EGFR 변이 검출 검사를 진행한 결과, 93%의 T790M 변이를 검출했으며, L858R 변이와 Exon19 결실 역시 80%이상의 변이를 발견했다. 또한 혈액의 경우, T790M 변이는 93%, L858R 변이는 100% 변이 발생 환자를 감지했다.
트로바진은 이 연구를 토대로 ‘Trovera’ 플랫폼 기술이 소변과 혈액에서 종양으로부터 유래된 순환종양DNA를 검출하는데 뛰어난 민감도와 정확성을 가진다는 것을 확인했다고 밝혔다. 트로바진의 CSO로 재직 중인 마크 얼랜더(Mark Erlander)는 당시 보도자료에서 “Trovera는 소변과 혈액샘플 모두에서 변이를 알아낼 수 있는 유일한 액체생검 테스트"라면서 "비침습적인 방법으로 환자와 헬스케어 제공자에게 암 또는 정밀의료에 대한 정보를 제공하겠다"고 강조했다.




![[인사]한미그룹, 임원 승진 인사](https://img.etoday.co.kr/crop/74/74/2071974.jpg)














