국제
길리어드, 류마티스 치료제 ‘필고티닙’ "연내 NDA 제출"
바이오스펙테이터 봉나은 기자
갈라파고스 개발 JAK1 저해제..MTX 단일 복용군 대비 류마티스 관절염 개선 효능 보인 임상3상 결과 반영, 올해 내 NDA 제출 예정

길리어드 사이언스(Gilead Sciences)와 갈라파고스(Galapagos)가 함께 개발 중인 '필고티닙(filgotinib)'이 신약승인에 한발 다가섰다. 길리어드는 올해 안에 류마티스 관절염 치료제로 필고티닙에 대한 신약승인신청서(New drug application, NDA)를 미국 식품의약국(FDA)에 제출할 계획이라고 지난 2일 발표했다. 필고티닙이 FINCH 3 임상3상에서 1차 종결점을 충족했다는 결과가 나온지 3개월만의 일이다.
필고티닙은 야누스 인산화효소 1(Janus kinase 1, JAK1)을 선택적으로 저해하는 경구용 JAK1 저해제다. 갈라파고스가 개발하고, 2015년 길리어드와 다양한 질환을 대상으로 공동 개발 및 상용화하는 계약을 맺었다. 길리어드는 현재 필고티닙을 이용해 류마티스 관절염, 궤양성 대장염, 크론병을 대상으로 한 임상3상, 이외 다양한 염증 질환을 대상으로 한 임상2상을 진행하고 있다.
길리어드는 FDA와 필고티닙에 대한 Pre-NDA 미팅에서 중등도 및 중증 활성 궤양성 대장염 또는 크론병 환자를 대상으로 진행 중인 ‘MANTA 임상2상’과 류마티스 관절염 환자를 대상으로 진행 중인 ‘FINCH 임상3상’을 논의한 가운데, 류마티스 관절염 대상의 NDA를 올해 안에 제출할 수 있을 것으로 전망했다. NDA에는 여러 FINCH 임상3상 결과들이 포함될 예정이다.
한편, 길리어드는 지난달 스페인 마드리드에서 열린 2019 유럽류마티스학회(EULAR)에서 2개의 FINCH 임상 3상(FINCH 1, FINCH 3) 결과를 발표했다.
길리어드는 FINCH 1 임상(NCT02889796)에서 MTX(Methotrexate)에 치료 반응이 충분치 않은 중등도 및 중증 활성 류마티스 관절염 성인 환자에게 필고티닙 또는 애브비(AbbVie)의 휴미라(Humira, 성분명: adalimumab) 또는 위약을 처방해 효능을 확인했다. 치료는 최대 52주간 진행됐으며, 길리어드가 이번에 발표한 내용은 12주 결과다. 길리어드는 약물 복용 12주차에 1차 종결점으로 ‘약물 복용 후 관절염 증상이 20% 이상 개선됐음’을 뜻하는 ACR20(American College of Rheumatology 20% response)을 평가한 결과, 필고티닙 복용군이 이를 충족했다. 2차 종결점으로 평가한 ACR50, ACR70도 위약 복용군보다 높은 비율을 나타냈다. 또한 필고티닙 200mg은 휴미라 대비 비열등함을 보이기도 했다.
FINCH 3 임상(NCT02886728)에서는 MTX를 치료받은 경험이 없는 중등도 및 중증 활성 류마티스 관절염 환자에게 필고티닙을 단일 처방하거나 MTX와 병용 처방해 효능과 안전성을 확인했다. 전체 환자 1252명 중 1249명이 약물을 처방받았으며, 환자는 무작위로 필고티닙 200mg+MTX 복용군(416명), 필고티닙 100mg+MTX 복용군(207명), 필고티닙 200mg 단일 복용군(210명), MTX 단일 복용군(416명)으로 나뉘었다. 치료는 최대 52주간 진행됐으며, 길리어드가 이번에 발표한 내용은 분석이 완료된 환자 1130명의 24주 결과다.
길리어드는 24주차에 1차 종결점으로 ACR20을 평가해 이를 충족했다. 필고티닙 200mg+MTX 복용군의 81%, 필고티닙 100mg+MTX 복용군의 80.2%, MTX 단일 복용군의 71.4%가 ACR20을 달성했다. 2차 종결점으로 평가한 ACR50, ACR70에서도 필고티닙+MTX 복용군이 MTX 단일 복용군보다 높은 비율을 나타냈다.
길리어드는 질병 활성도를 나타내 임상적 관해를 보여주는 DAS28-CRP(Disease activity score 28-joint count C-reactive protein) 점수도 평가했다. 약물 복용 전 환자들의 평균 DAS28-CRP 점수는 5.7점이었으나, 약물 복용 24주차에 필고티닙+MTX 복용군의 점수는 2.6점 미만, 필고티닙 단일 복용군은 3.2점 이하로 감소했다.
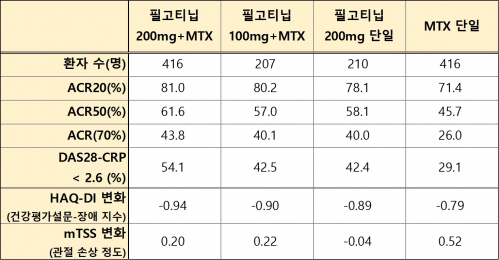
▲FINCH 3 임상3상 결과(바이오스펙테이터 재구성)
이밖에도 길리어드는 필고티닙과 MTX를 병용한 활성 류마티스 관절염 환자에게서 약물이 잘 통제되고, 류마티스 관절염 개선에 비교적 유의미한 효능이 관찰됐다고 발표했다. 안전성 프로파일은 이전 임상 결과와 동일했다.

















