국제
로슈, 코로나19 면역진단 '민감도100%, 특이도 99.8%'
바이오스펙테이터 서일 기자
FDA 긴급사용승인..코로나19 항체분석 ‘Elecsys® Anti-SARS-CoV-2 serology test’

로슈(Roche)의 코로나19 면역진단법인 ‘Elecsys® Anti-SARS-CoV-2 serology test'가 미국 식품의약국(FDA)의 긴급사용승인(EUA)을 받았다.
로슈는 지난 4일(현지시간) 코로나19 감염에 대한 항체를 검사하는 ‘Elecsys® Anti-SARS-CoV-2 serology test'가 미 FDA에서 긴급사용승인(emergency use authorization, EUA)를 받았다고 밝혔다. 로슈가 개발한 이 테스트는 혈청(serum)과 혈장(plasma)에서 코로나19에 대한 항체를 탐지하는 면역진단(immunoassay)법이다.
로슈는 Elecsys® Anti-SARS-CoV-2 serology test로 5272개의 샘플을 분석한 결과 99.8%의 특이도(specificity)를 보였으며, 감기를 유발하는 다른 4개의 인간 코로나바이러스와 교차반응을 보이지 않았다고 설명했다. 또, RT-PCR로 신종 코로나바이러스(SARS-CoV-2)의 감염을 확인하고 14일후 채취한 샘플에서 100%의 민감도(sensitivity)를 나타냈다.
로슈는 Elecsys® Anti-SARS-CoV-2 serology test를 통해 신종 코로나바이러스의 감염여부와 항체 생성여부를 확인할 수 있다고 밝혔다. 로슈는 병원과 연구소에서 자사의 ‘코바스e 애널라이저(Cobas e analyzer)’를 이용해 검사할 수 있고 한번 진단에 약 18분의 시간이 소요되며 시간당 최대 300개의 샘플을 분석할 수 있다고 설명했다.
세버린 슈완(Severin Schwan) 로슈그룹 CEO는 “고품질의 면역진단법을 제공함으로써 코로나19로 인한 위기를 관리 할 수 있도록 전세계의 의료 시스템을 지원할 것”이라며 “면역진단법의 높은 특이성과 민감도에 고무적이다”고 말했다.
한편, 현재까지 FDA에서 긴급사용승인을 받은 면역진단법은 12개로 로슈를 비롯해, 애보트(Abbott), 바이오라드(Biorad), 셀렉스(Cellex) 등이 있다.
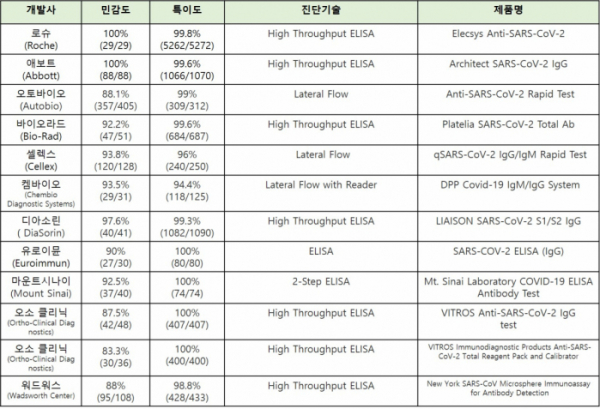
▲FDA에서 긴급사용승인(EUA)한 12개의 면역진단법(FDA 홈페이지 참조)


















