기업
프로젠, ‘GLP-1/2 작용제’ 연구결과 “ADA 2건 발표”
바이오스펙테이터 서윤석 기자
[ADA 2024]‘PG-102’ 전임상 및 임상1a상 결과 포스터 발표..당뇨 마우스모델서 당화혈색소(HbA1c) 감소효과, 임상1a상에서 안전성, 내약성 확인

프로젠(Progen)은 24일 미국 올랜도 컨벤션센터에서 열린 제84회 미국 당뇨병학회(ADA 2024)에서 GLP-1/GLP-2 이중작용제 후보물질 ‘PG-102’의 전임상 및 초기 임상결과를 포스터 세션에서 발표했다고 밝혔다.
PG-102는 프로젠의 다중 표적 융합단백질 플랫폼 ‘NTIG®’ 기술을 적용한 GLP-1/GLP-2 이중작용제 후보물질로 장기능 개선, 지방조직의 당 흡수 촉진, 만성염증 개선 등 GLP-2의 효능과 시너지를 가지는 비만 및 당뇨병 치료제로 개발하고 있다.
프로젠은 PG-102를 투여한 비만 동반 제2형 당뇨병 마우스모델에서 대조약물로 사용한 세마글루타이드(semaglutide), 터제파타이드(tirzepitide), 레타트루타이드(retatrutide)보다 우수한 혈당감소 효과를 보였다. 구체적으로 세마글루타이드, 터제파타이드, 레타트루타이드는 각각 최대 1.8%, 2.5%, 2.5% 수준의 당화혈색소(HbA1c) 감소를 보인 반면, PG-102는 당화혈색소를 5.2% 낮추며 정상범위에 도달했다.
마우스모델의 췌장조직 분석한 결과, PG-102는 세마글루타이드와 터제파타이드와 비교해 인슐린을 분비하는 베타 세포 면역비율이 더 큰 것으로 나타났다. 또 마우스모델의 근육세포와 지방세포에서 대조약물과 비교해 높은 당흡수 효과를 보였다고 회사는 설명했다.
또 프로젠은 PG-102의 단회투여 용량증량(SAD) 임상1a상 결과를 보였다. 프로젠은 평균 BMI 23.8kg/㎡인 40명의 임상참여자를 대상으로 PG-102 5mg, 15mg, 30mg, 60mg과 위약을 각각 8:2의 비율로 투여했다.
분석결과 PG-102는 우수한 안전성과 내약성을 보였다. 주로 발생한 부작용은 소화불량, 메스꺼움, 구토 등 위장관계(GI) 부작용이었으며, 대부분 경증에서 중등도로 확인됐다.
프로젠은 임상1상과 전임상 연구결과의 약동학/약력학 시뮬레이션을 통해 PG-102을 격주 또는 월 단위로 투여제형으로 개발 가능성을 확인했다고 설명했다.
김종균 프로젠 대표는 “GLP-1과 GLP-2 수용체에 대한 활성비율을 최적화한 PG-102의 차별점과 우수성을 전임상 및 초기 임상연구를 통해 확인했다는 점에서 의미 있는 결과”라며 “현재 진행 중인 PG-102의 임상1b상의 신속한 마무리와 임상2상 준비를 차질없이 진행해 비만·당뇨병 시장에서 경쟁력을 갖춘 신약으로 성공 가능성을 높여가겠다”고 말했다.
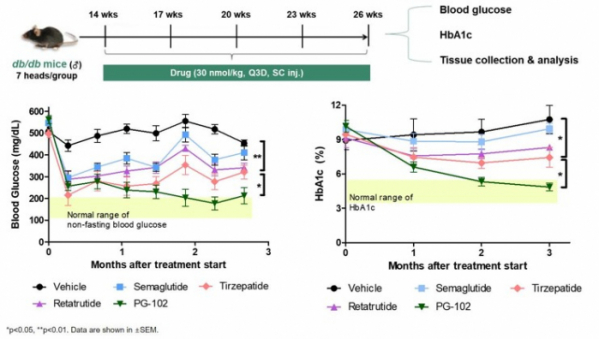
▲당뇨병 마우스모델에서 PG-102의 혈당강하 효과(ADA 2024 프로젠 초록 참조)














