BioS+
[이종혁 교수의 약가협상]④독일의 보험약가제도
바이오스펙테이터 천승현 기자
가. 신약의 등재절차
독일의 보험약가 등재는 네거티브방식으로 대상의약품이 정해지므로, 등재 대상 의약품을 선별하는 절차없이 비급여목록에 해당되지 않을 경우 모두 보험급여가 적용된다. 따라서, 신약이 시판승인이 되면 약가가 결정되기 전까지 자유가격으로 급여가 가능하다.
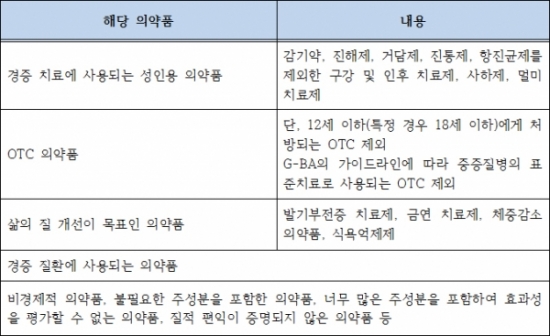
▲독일의 Negative List 품목분류
연방공동위원회(Gemeinsamer BundesAusschuss, G-BA)는 건강보험조합으로 환자, 의사, 병원을 대표하는 건강보험 관련 최고의사결정기구로 연방보건부의 감독을 받는다. 의약품과 관련해서는 OTC의약품 중 급여대상 적응증 선정, 비급여목록에 포함될 의약품 선정, 참조가격 대상의약품의 클러스터 분류 등을 결정한다. 공적건강보험조합연합회(GKV-SV)에서는 치료재료, 의약품에 대한 가격결정(협상) 및 서비스의 질에 대한 관리 등을 한다.
2011년에 독일정부는 약품비 지출증가를 억제하기 위하여 의약품 시장 개혁법안(AMNOG)을 시행하였다. 제약사는 신약의 비용편익보고서를 G-BA에 제출하여야 하고, IQWiG는 G-BA의 의뢰를 받아 신약의 비교대안 대비 치료적 효과의 우월성, 소요비용 등을 비교 검토한다. IQWiG의 3개월간의 임상적 편익 평가 후 그 평가결과가 홈페이지에 공개되면, 유관기관 및 전문가 등의 의견수렴 후 3개월 내에 임상적 비용편익의 등급(1~6등급)을 결정한다. 추가적인 임상적 편익이 있는 경우(1~4등급)에는 제약사와 GKV-SV간의 협상을 통하여 가격, 환급 및 할인율을 결정한다. 임상적 편익이 없는 경우(5, 6등급)에는 참조가격제 대상으로 분류하고, 적용 가능한 참조가격군이 없는 경우에는 가격협상을 통하여 가격을 결정한다.... <계속>



















