피플
천연물 '리나룰' 나노입자, 난소암 항암 매커니즘 밝혀내
바이오스펙테이터 조정민 기자
건국대 박영민·한희동 교수 연구논문, 'Faculty of 1000Prime'에 선정.."활성산소 활성화해 종양세포 저해"

▲건국대 박영민 교수, 한희동 교수.
허브 등 식물에서 추출한 천연물질인 리나룰(linalool)의 항암효과를 활용해 암 환자 특히 화학항암제 내성 환자를 위한 치료제 개발이 국내 연구진에 의해 본격화되고 있다. 관련 연구는 지난해 국제 학술지 'Molecular cancer therapeutics'에 게재된 데 이어 지난달에는 세계 8000여 명의 생물학·의학 전문가들이 매달 상위 2%의 중요 논문을 선정하는 영국의 우수 논문 색인 시스템 'Faculty of 1000Prime'에 추천 논문으로 선정됐다.
16일 업계에 따르면 박영민·한희동 건국대 교수 연구팀(면역학)은 리나룰을 항암제로 활용가능한 나노입자 시스템을 개발하고 세포실험과 동물실험을 통해 상피성난소암에서의 항암작용 메커니즘을 밝히는데 성공했다.
상피성 난소암은 수술과 화학적 치료에 긍정적 초기반응을 보이지만 세포독성약물에 대한 내성을 가진 암세포가 발생하는 현상으로 새로운 치료제 개발이 요구되는 질환이다.
연구팀은 항종양성 항생물질인 독소루비신(doxorubicin)의 암세포 유입을 활성화하는 천연물질인 리나룰을 활용했다. 다만 리나룰은 항암제로 개발하기 위한 다양한 연구가 진행됐지만 물에 녹지않는 비수용성 성질인데다 액상 형태여서 치료제로 개발하기에 어려움이 있었다.
연구팀은 나노입자를 통해 리나룰의 한계를 극복했다. 나노입자는 투과성(permeability)과 정체성(retention)을 증진시켜 타깃 조직안에서의 약물 농도를 높이고 정상조직으로의 침투를 제한할 뿐만 아니라 약의 반감기를 늘려 타깃 암조직에 약물을 효과적으로 전달할 수 있다.
연구팀은 유화제를 이용한 자가나노유화 약물전달시스템(self-nanoemulsifying DDS)으로 'LIN-NPs'를 개발하고 상피성난소암 세포주에 처리했을 때 LIN-NP의 농도에 따라 세포(암세포) 생존율이 낮아지는 것을 확인했다.
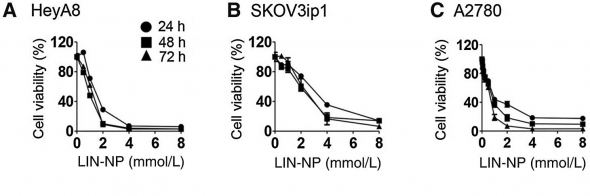
▲리나룰 농도에 따른 암세포주의 세포생존율.(출처:Molecular cancer therapeutics 논문)
또한 암세포 자멸에 영향을 미치는 LIN-NP의 기전을 확인하기 위한 실험을 진행, LIN-NP를 처리하면 세포 내의 활성산소(Reactive oxygen species)의 발생이 증가하는 것을 관찰했다. 리나룰이 기존 항암화학제처럼 종양세포를 저해하는 것이 아닌 세포 내부에서 활성산소(ROS)를 증가시켜 종양세포를 저해하는 메커니즘임을 밝힌 것. 기존 항암제가 듣지 않는 내성 환자에 적용가능하다는 의미다.
연구진은 암세포주 이식동물모델을 이용해 LIN-NP의 효능을 관찰했다. 암세포주를 복강주사를 통해 마우스에 주입하고 7일 뒤, LIN-NP를 각각 50mg/kg와 100mg/kg로 처리하고 대조군(PBS처리)과 100mg/kg용량의 종양 무게를 비교했을 때, 유의미한 감소효과를 확인했다. 이때 부작용의 척도로 사용하는 몸무게는 거의 차이가 나지 않았다.
또한 종양조직을 채취해 단백질의 발현양을 비교하자 종양의 미세혈관밀도를 확인하기 위한 지표로 사용되는 CD31은 감소하고 세포자멸 신호단백질인 caspase-3의 발현양은 증가한 결과를 얻었다. 종양의 크기는 감소하고 암세포의 자멸이 증가한 것이다.
연구팀은 기존 난소암 1차치료제로 사용되는 파크리탁셀(Paclitaxil)과의 병용투여 효과도 확인했다. 환자유래 이종이식모델(PDX)모델에서도 파크리탁셀의 단독투여와 LIN-NP와의 병용투여로 군을 나눠 종양크기와 무게를 측정한 실험에서도 병용투여시 단독투여에 비해 종양크기와 무게가 유의미하게 줄어들었다.

▲환자유래 이종이식(PDX)모델에서의 병용투여 효능 확인. (출처: Molecular cancer therapeutics)
한 교수는 "이번 연구는 리나룰을 나노입자화해 주사가 가능하게 했을뿐 아니라 주사 후에 동물실험과 환자의 모델를 이용해 항암효능을 입증한 것"이라면서 "기존의 항암화학제에 내성이 생긴 환자들에게 새로운 치료방법을 제시하는 한편, 기존 항암화학제와 병행치료시에 약물의 민감성을 개선해 항암치료 효능을 극대화시킬 수 있다"고 말했다.
연구팀은 현재 실험 결과를 보완 및 시스템을 최적화하기 위한 연구를 진행하고 있으며 관련 특허도 출원했다. 특히 리나룰 나노입자와 항암제를 동시에 탑재할 수 있는 주사제형을 개발해 단독치료뿐 아니라 기존 항암제와 병용요법으로 활용하는 연구도 진행하고 있다.

















