BioS+
[이종혁 교수의 약가협상]⑥프랑스의 보험약가제도
바이오스펙테이터 천승현 기자
가. 신약의 등재절차
유럽의약품청(EMEA) 또는 프랑스의약품청에서 시판허가를 득한 의약품은 보건부(French National Authority for Health, 이하 HAS) 산하의 투명위원회(Commission de la Tranparence, 이하 CT)에서 임상적 편익 등에 대한 기술적 검토가 이루어진다. 그 결과에 따라서 임상적 편익정도(SMR) 및 기존 치료제 대비 임상적 편익 개선수준(ASMR)이 결정되면, 의약품경제평가위원회(Economic Committee for Health Products, 이하 CEPS)는 CT의 자문을 받아 해당 제약사와 협상을 통하여 약가를 결정하게 된다.
CT에서는 급여 적정성에 대한 기술적 평가를 통해 HAS에 기술적 조언을 한다. 이를 바탕으로 CEPS는 제약사와 약가협상을 통해 세금제외 공장도가(Prix Fabricants Hors de Taxes, PFTH)를 결정하게 된다.
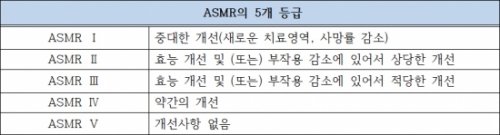
약가협상 시에는 의약품의 임상적 편익 개선수준(ASMR), 대체의약품의 가격, 예상사용량, 예측가능한 처방실태 등을 고려하여 협상한다. 또한, 예상사용량 또는 지출을 초과할 경우의 환급에 관한 계약(framework agreement, Accord cadre)을 하고, 이에 따라서 약가 및 약품비지출의 관리가 이루어진다. ASMR은 기존의 치료제와 비교하여 개선된 정도에 관한 것으로 5등급 level Ⅰ(major), level Ⅱ(significant), level Ⅲ(moderate), level Ⅳ(low), level Ⅴ(no impressment)으로 구분되며, 그 등급에 따라 약가가 결정된다.