바이오스펙테이터 천승현 기자
식약처, 이상사례 분석 결과 7개 성분 허가사항 변경
식품의약품안전처는 지난 1989년부터 2015년까지 의약품 사용 후 보고된 이상사례를 분석·평가해 '아목시실린' 등 등 7개 성분 582개 품목 허가사항에 새로운 이상사례를 추가하는 안전조치를 실시했다고 21일 밝혔다.
허가변경 대상은 아목시실린, 실로스타졸, 알로포로스트, 티카그렐러, 레미펜타닐, 클로피도그렐 등이다. 해당 성분에 대한 이상사례 정보를 한국의약품안전관리원이 분석한 실마리정보를 바탕으로 하여 중앙약사심의워원회의 자문을 거쳐 최종 결정됐다.
항생제 ‘아목시실린’(먹는 약 및 주사 약)은 사용상 주의사항에 혈관부종, 반점구진발진 등이 발생한다는 내용이 추가된다. ‘아목시실린과 클라불란산 복합제’는 피부염 등 발생이 추가된다.
심혈관계 의약품 ‘실로스타졸’은 감각저하, 폐동약고혈압 증상 개선제 ‘일로프로스트’는 객혈 발생 등이 각각 새롭게 반영된다. 항혈전제 '클로피도그렐'은 담낭염과 토혈 등이 발생할 수 있다는 내용이 허가사항에 추가된다.
식약처 관계자는 "이번 조치가 이들 의약품을 사용하는 의사, 약사, 환자에게 이상사례 발생 등에 대한 정보를 사전에 알려 국민들이 안전하게 의약품을 사용하는데 도움이 될 것"이라며 "앞으로도 이상 사례 등을 지속적으로 점검, 필요한 안전조치를 실시하겠다"고 말했다.
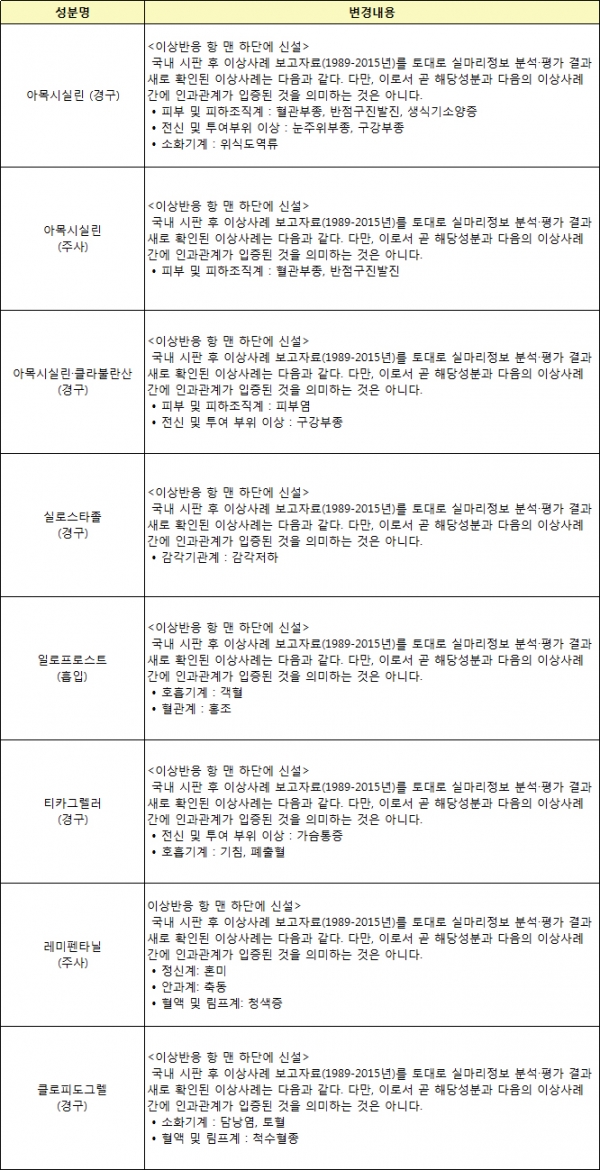
▲식약처 허가사항 변경지시 대상과 내용







![[인사]삼성바이오로직스, 2025년 임원승진 인사](https://img.etoday.co.kr/crop/74/74/2108615.jpg)





![[인사]삼성바이오에피스, 2025년 정기 임원인사](https://img.etoday.co.kr/crop/77/77/2108613.jpg)
![[인사]삼성바이오로직스, 2025년 임원승진 인사](https://img.etoday.co.kr/crop/77/77/2108615.jpg)
![[인사]삼성바이오에피스, 2025년 정기 임원인사](https://img.etoday.co.kr/crop/74/74/2108613.jpg)


