오피니언
이상적 표적항암제 'Magic Bullet'을 향한 도전
오영수 레고켐바이오사이언스 연구소장
[바이오스펙테이터 창간 1주년 기고⑩]오영수 레고켐바이오사이언스 연구소장

정상세포에 전혀 독성을 나타내지 않고 질환을 일으키는 인자만 제거하는 이상적인 표적치료제 매직 불릿(Magic Bullet, 마법의 탄환) 개념은 1913년 폴 에를리히(Paul Erlich)에 의해 제기되었다. 서로 다르게 보이는 생각을 통합하는 능력이 뛰어난 학자였던 그는 독소 치료를 위해 항독소를 사용하는 것을 넘어 화학적 특이성을 가진 치료제를 사용해 정상세포와 질병세포를 구분하여 치료할 수 있을 것이라고 가정하였다. 그리고 뛰어난 약효와 안전성을 모두 갖춘 치료제를 '매직 불릿'이라는 새로운 개념으로 제약 산업에 제시하였다.

1910년대에 시작하여 이런 약을 개발하고자 하는 도전은 100년 이상 지속돼 왔다. 하지만 아직까지 이러한 개념을 성공적으로 실현하여 약효와 안전성을 모두 혁신적으로 개선한 신약은 아직까지 개발되지 않았다. 가장 먼저 매직불릿이 될 것으로 기대 되었던 1세대 ADC, 캐사일라(Kadcyla)는 최종제품이 혼합물이라는 점과 혈중 링커의 불안정성으로 인하여 약효와 안전성 측면에서 이상적 치료제로서의 기대를 충족시키지 못하였다. 다음으로 주목 받았던 의약품은 주노 테라퓨틱스(Juno Therapeutics)의 면역항암제 CAR-T 였으나 최근 5명의 환자를 사망에 이르게 하며 예측하지 못했던 안전성 측면에서 치명적인 결함을 드러낸 바 있다.
◇차세대 표적 치료제로서 ADC의 강점: 예측 가능성
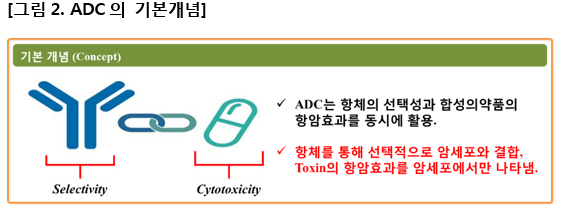
현재 차세대 항암제로 개발되고 있는 여러 계열의 약물들 중 ADC가 가지는 가장 큰 장점은 바로 예측 가능성이다. ADC는 암세포에 특이적으로 결합하는 항체와 항암효과를 가지는 독소(Toxin)를 링커로 연결, 정상세포에 대한 독성을 최소화 하는 동시에 암세포에 대한 약효를 극대화 한다.
다른 계열의 차세대 치료제인 면역항암제(Immunotherapy)는 합성의약품의 독성 대신 면역체계를 활용하여 선택성과 약효를 확보한다. 현재 추가로 개발되고 있는 PDC(Protein-Drug Conjugate)의 경우는 항체보다 크기(분자량)가 작은 단백질을 활용한다. 이를 통해 치료제가 표적세포 안으로 더 잘 파고들게 하여 약효를 높이는 한편, 반감기를 줄여 부작용을 최소하는 등 새로운 장점을 활용하여 보다 더 마법의 탄환에 가까운 약으로 개발하고 있다.
하지만 어떠한 치료제도 현재 매직 불릿의 기대를 충족하고 있지 못하다. CAR-T의 사례가 잘 보여주듯이 T 세포를 활용한 항암치료는 선택적이면서도 항암효과가 높았지만 면역체계를 변형시키는 부작용을 학계도 산업계도 예측하지 못하였다. 이와 마찬가지로 일부 새로운 단백질(Protein)들이 암세포와 결합력이 높고 파고드는 측면에서 효율적이긴 하지만 이러한 개체가 어떻게 몸에서 흡수, 분포, 대사 되는 지에 대한 연구는 부족하다.

이러한 여러 계열의 약물 중 ADC의 가장 큰 장점은 다른 두 차세대 치료제 대비 약효와 안전성 그리고 부작용이 예측 가능하다는 점, 그리고 임상에서 검증이 여러 차례 이루어 졌다는 것이다.
항체는 이미 어떠한 과정을 거쳐서 암세포를 선택적으로 인식하는지에 대한 분석의 연구가 많이 진행되었다. 대규모 임상을 하지 않고도 바이오시밀러(Biosimilar)를 만들 수 있을 정도로 작용기전(MOA)에 대한 지식과 분석 방법을 이미 산업 단위로 갖춘 것이다. 톡신은 항체보다도 훨씬 오랜 기간에 걸쳐 연구 분석된 바 있다. 그리고 이러한 두 요소를 연결시킨 ADC 자체에 대해서도 최초의 ADC가 허가 받은 2000년대 초반을 기점으로 매우 활발한 연구가 이루어졌다.
실제로 ADC라는 블록버스터 신약을 허가 받아 판매하려는 제약사의 입장에서 이러한 예측 가능성은 매우 중요한 결정 요소이다. 흔히들 신약의 개발을 하이 리스크, 하이 리턴(High Risk, High Return)이라고 표현한다. ADC는 구성요소들의 분석을 통해 미디어 리스크, 하이 리턴(Medium Risk, High Return)을 얻을 수 있다는 것이 다른 차세대들과 가장 두드러진 차이점이다.
◇ADC, 매직 불릿이 되기 위해 필요한 진보
이상적인 항암제가 가지는 두 가지 조건은 단순하다. 안전하고 효과가 좋으면 된다. 1세대 ADC는 두 가지 측면 모두에서 매우 부족한 모습을 보였다. 그렇다면 두 가지를 개선하기 위해 ADC는 어떻게 개선되어야 하는가? 먼저 ADC는 3가지 부분으로 구성되어 있다.

그리고 표에서 설명된 내용처럼 각각의 구성요소는 고유의 기능을 가진다. 항암제로서 환자의 혈관에 투여된 ADC는 항체를 통해 정상세포와 암세포를 구분하고, 달려있는 톡신이 암세포에서 항암효과를 발현한다. 두 물질을 연결한 링커는 혈중에서 톡신이 분리되어 정상세포에 대해 독성을 일으키지 않도록 안정적으로 연결 함으로써 치료제의 안전성에 많은 부분을 담당하게 된다.
1세대 ADC 치료제인 캐사일라(Kadcyla)와 애드세트리스(Adcetris)는 항체에 약물이 연결되도록 어느 정도 개념을 구현한 것이다. 그리고 1세대의 부족한 약효와 안전성을 어느 정도 개선한 기술들을 통칭하여 현재 2세대 ADC 기술로 설명하고 있다.
이제 1세대 ADC 나온 뒤 약 10년이 지났고 2세대 기술들이 다수 개발되어 그들 간에도 기술의 진보 정도에 많은 차이가 존재한다. 이러한 흐름에 따라 학계에서도 이제는 ADC 기술의 세대를 보다 세분화해야 한다고 주장이 나오고 있지만 아직 절대적 기준이 확립되지는 않은 상태이다. 하지만 한 가지 확실한 것은 명목적인 세대의 구분보다는 서두에서 설명한 것과 같이 약효와 안전성이 뛰어난 ADC가 가장 좋은 ADC라는 것이다.
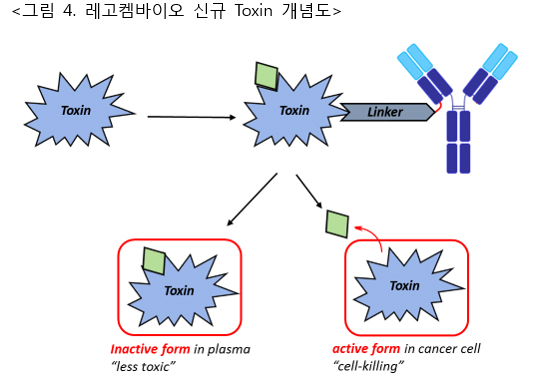
레고켐바이오는 글로벌 단위에서도 혈중에서 가장 안정적인 링커를 사용하고 있다. ADC를 제조할 때 경쟁기업과 동일한 항체 그리고 톡신을 사용할 경우 약효와 안전성 측면에서 우위를 가져갈 수 있다는 것이다. 그리고 이제는 항체와 톡신의 링커 결합 방법론을 넘어 새로운 방법으로 ADC 기술을 개선하고 있다.
이 중 한 분야가 레고켐바이오 고유의 'Medicinal Chemistry'를 활용한 새로운 ADC용 톡신의 연구개발이다. 현재 가장 많이 ADC에 적용 중인 튜불린(tubulin) 억제 톡신들은 세포 분열이 느린 암세포에는 약효가 떨어지고 내성을 가지는 암종들이 속속 출현하고 있는 단점을 가지고 있다. 이를 극복하고자 다른 작용 메커니즘(DNA혹은 RNA 타깃)을 가지는 톡신들이 최근 ADC연구에서 각광을 받고 있다. 하지만 이들 톡신은 항암효과가 뛰어나지만 독성이 높고 구조적으로 불안정하여 ADC로 활용되기 매우 어려웠다. 레고켐바이오는 이들 톡신에 새로운 구조적 형질을 부여, 당사 고유의 링커가 혈중에서는 안정적이고 암세포 안에서 잘 분열되는 것과 같이 특정 조건에서만 항암효과를 발현하도록 연구를 진행 중에 있다. 이 새로운 기술이 기존 ADC 플랫폼과 결합하여 시너지를 나타내게 된다면 ADC는 보다 Magic Bullet에 가까운 표적항암제가 될 것으로 기대된다.