기업
올릭스, 비대흉터치료제 영국 1상 임상시험 신청
바이오스펙테이터 장종원 기자
1년간 임상 진행 후 기술이전 가속화 전망..이달 코스닥 상장 예비심사 청구

RNAi 기반 신약개발기업 올릭스가 비대흉터치료제 후보물질의 영국 임상을 본격 추진한다.
올릭스는 12일 비대흉터치료제 후보물질 OLX10010의 1상 임상시험 허가신청서(Clinical Trial Authorization; CTA)를 영국 보건당국(MHRA)에 제출했다고 밝혔다.
올릭스가 RNA간섭을 효과적으로 유도하는 플랫폼기술과 관련 특허를 통해 개발중인 비대흉터치료제는 국내에서는 바이오의약품기업인 휴젤이 아시아지역 판권을 이전 받아 1상 임상시험을 진행하고 있다. 올해 상반기 중 종료 예정이다.
영국 임상시험은 올릭스가 직접 진행하며, 임상시험기관은 글로벌 기업인 코반스로 정했다. 올릭스는 코반스와 글로벌 임상개발 관련 전략적 제휴를 체결하는 등 긴밀한 협업체계를 갖추고 있다. 이번 임상시험 1상은 승인 후 약 1년간 진행 예정이며, 안전성을 평가하는 1상 종료 후에는 명확한 작용기전을 갖고있는 핵산치료제 특성상 기술이전이 가속화될 수 있을 것으로 회사측은 예상하고 있다.
수술 또는 외상으로 인해 피부 진피 깊이까지 손상됐을때, 진피층 콜라겐의 과다 증식으로 상처 치유 이후에도 얇아진 피부를 돌출해 흉터가 남게 되는데, 이 과정이 비정상적으로 과다하게 일어나는 경우를 비대흉터(hypertrophic scar)라고 한다. 수술환자의 약 32%가 1년 이내에 비대흉터로 발전할 정도로 흔하게 발견되지만 아직까지 이를 효과적으로 치료할 수 있는 승인된 전문의약품이 없고 실리콘 시트나 압박요법 같은 불충분한 보조요법만 사용하는 실정이어서 의학적 미충족 수요가 높은 분야이다.
올릭스의 비대흉터치료제 후보물질 OLX10010은 콜라겐 생성에 핵심적인 역할을 하는 결합조직생성인자(Connective Tissue Growth Factor; CTGF)를 목표 유전자로 하며, 올릭스의 플랫폼인 자가전달 비대칭 siRNA(cp-asiRNA) 투여 시 CTGF 발현을 막아 콜라겐 생성을 억제하여 비대흉터 생성을 막는 것이다.
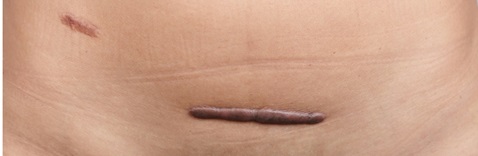
▲비대흉터
올릭스 관계자는 "바이오의약품기업 휴젤에 비대흉터치료제의 아시아 지역을 대상으로 하는 기술이전을 개발초기단계에 완료했으며, 아시아 외 지역에 대해서 다국적 제약사와 기술이전을 위한 실사 및 협상을 진행하고 있다"고 전했다.
올릭스의 이동기 대표는 “'2018 JP모건 헬스케어 콘퍼런스'에서 올해의 키워드로 선정된 RNA 간섭기술의 선도기업으로 올릭스는 이번 영국 임상시험을 통해 기술의 완성도를 한 단계 더 높일 수 있는 계기가 될 것”이라고 자신감을 표했다.
한편 올릭스는 작년 10월 코스닥 상장을 위한 기술성평가를 통과했으며 이달 중 코스닥 상장 예비심사를 청구할 계획이다.



















