국제
아이거, 첫 조로증 치료제 '조킨비' "美 FDA 승인"
바이오스펙테이터 윤소영 기자
조킨비 복용군서 사망위험률 77%↓..D형 간염 임상도 진행중

미국 식품의약국(FDA)의 승인을 받은 첫 조로증(progeria) 치료제가 나왔다. 조로증은 전세계에서 수백명만이 앓고 있는 희귀질환이다.
아이거(Eiger therapeutics)는 지난 20일(현지시간) FDA가 ‘조킨비(Zokinvy, lonafarnib)’를 허친슨-길포드 조로증 증후군(Hutchinson-Gilford Progeria Syndrome, HGPS)과 특정 결함이 있는 조로증 돌연변이(Progeroid Laminopathies, PL)의 치료제로 승인했다고 밝혔다.
허친슨-길포드 조로증 증후군(HGPS)과 조로증 돌연변이(PL)는 어린 환자들에게서 일찍 노화가 시작되는 서로 다른 유전질환이다. 허친슨-길포드 조로증 증후군은 LMNA 유전자의 점 돌연변이(point mutation)로 인해 파르네실화(farnesylated)된 비정상적인 단백질인 프로게린(progerin)의 생성으로 발병한다. 조로증 돌연변이는 LMNA 혹은 Zmpste24 유전자의 돌연변이로 인한 파르네실화 단백질의 생성으로 노화가 가속화되는 유전질환이다. 조로증 돌연변이는 프로게린과 관련이 없지만 나타나는 증상은 조로증과 비슷하다. 전 세계에 허친슨-길포드 조로증 증후군 환자는 400명, 조로증 돌연변이 환자는 200명 정도 있을 것으로 추산된다. 치료를 받지 않으면 조로증의 아이들은 대부분 심장질환으로 평균 14.5세에 사망한다.
조킨비(Zokinvy, lonafarnib)는 파르네실화된 단백질의 축적을 막는 경구용 약물이다. 아이거는 조킨비가 HGPS나 PL외의 다른 조로증에는 사용될 수 없다고 명시했다.
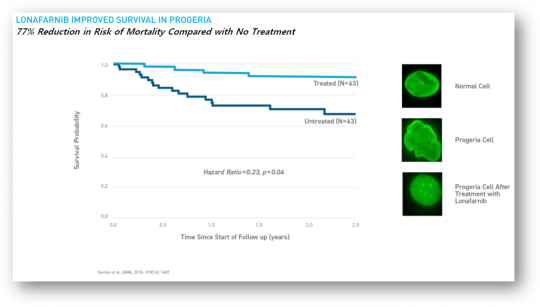
아이거는 이번 승인의 바탕이 된 5가지의 임상을 진행하는 동안 90명 이상의 조로증 환자에게 조킨비를 투약했다고 설명했다. 아이거에 따르면 그중 한 임상은 126명의 조로증 환자를 대상으로 진행됐으며, 63명은 150mg/m^2의 조킨비를 매일 2번씩 단일복용했고 다른 63명의 환자는 복용하지 않았다(untreated). 그 결과 조킨비 복용군에서는 4명(6.3%)의 사망환자가 발생했고, 복용하지 않은 군에서는 17명(27%)의 사망환자가 발생했다. 아이거는 이 임상결과에 대해 평균 2.2년의 치료기간중 조킨비 복용군에서 복용하지 않은 군에 비해 사망위험률이 77% 감소했다고 발표했다.
이번 승인에서 아이거는 FDA로부터 우선심사권(Priority Review Voucher, PRV)을 획득했다. PRV는 소아 희귀질환이나 소외질환(neglected disease) 치료제를 개발한 회사에 대해 FDA 주는 바우처다. PRV가 있으면 회사는 다른 약에 대한 FDA 검토 기간을 10개월에서 6개월로 줄일 수 있으며 이를 다른 회사에 팔 수도 있다.
아이거는 지난 23일(현지시간) PRV를 9500만 달러에 팔았으며, 조로증연구재단(Progeria Research Foundation, PRF)과 맺은 계약에 따라 수익의 반인 4750만 달러를 PRF에 지급할 것이라고 밝혔다.
David Cory 아이거 CEO는 “조킨비의 FDA 승인은 조로증을 겪는 환자와 그 가족들을 위해 아이거와 PRF가 협력한 결과”라며 “치명적이고 희귀한 소아질환에 대해 아이거가 첫 약물 승인을 받아 기쁘고 조킨비 임상에 참여했던 모든 아이들과 가족들에게 감사를 전한다”고 말했다.
한편, 아이거는 2018년 미국 머크(MSD)로부터 조킨비의 전세계 독점권을 계약금 없이 받았으며 조킨비로 D형 간염 임상 3상도 진행하고 있다.
▲조킨비 임상 결과(아이거 홈페이지 참조)



















