국제
美 FDA, 심사수수료 인상.."신약 8%, 제네릭 15%↑"
바이오스펙테이터 윤소영 기자
바이오시밀러 수수료는 동결..전문의약품 심사수수료 311만7218달러로 올려

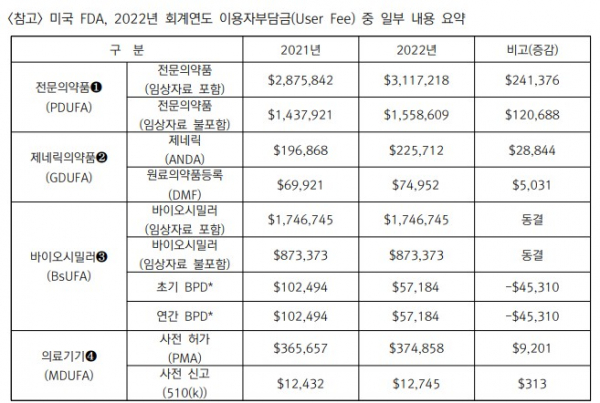
올해 10월부터 시작되는 미국 식품의약국(FDA)의 2022년 회계년도(FY) 예산이 34억1400만달러로 증가함에 따라 이용자부담금(User Fee)도 오른다. 전문의약품 신약에 대한 심사수수료는 311만7218달러(약 36억7000만원)로 전년대비 8.39% 늘어났다. 제네릭에 대한 심사수수료는 22만5712달러(약 2억6600만원)로 무려 14.65%나 올렸다. 하지만 바이오시밀러에 대한 수수료는 그대로 동결했다.
한국바이오협회가 17일 발표한 자료에 따르면 미국 상원세출위원회(The Senate Appropriations committee)는 FDA의 2022년(FY) 예산을 지난해보다 2억달러 증가한 34억1400만달러로 통과시켰다. 이 예산에는 27억2300만달러의 이용자부담금이 포함된다. 이용자부담금은 기업들이 FDA에 의약품 혹은 의료기기등의 시판 허가를 위해 내야하는 심사수수료이며 의약품이나 의료기기의 종류별로 비용에 차이가 있다.
이번 이용자부담금 예산은 처방의약품 수수료 11억4200만달러, 제네릭의약품 수수료 5억2800만달러, 의료기기 수수료 2억4100만달러, 바이오시밀러 수수료 4300만달러 등으로 구성됐다.
이에 심사수수료가 증가하게 됐는데, 전문의약품 심사수수료는 지난해에 비해 24만1376달러 상승한 311만7218달러, 제네릭의약품 심사수수료는 2만8844달러 증가한 22만5712달러가 됐다. 구체적으로 전문의약품의 경우 임상자료 검토 여부에 따라 심사 비용은 2배 차이가 있으며(임상자료 불포함의 경우 155만8609달러), 제네릭의약품은 생산시설의 소재에 따라 수수료 차이가 발생한다(미국 이외의 경우 더 비쌈).
다만 바이오시밀러 분야의 수수료는 동결 혹은 하락했다. 바이오시밀러의 심사수수료는 지난해와 동일한 174만6745달러(약 20억5700만원), 바이오시밀러의 개발지원 프로그램 비용은 지난해에 비해 4만5310달러 감소한 5만7184달러(약 6700만원)로 책정됐다. 바이오시밀러 역시 임상자료 검토 여부에 따라 비용차이가 2배 발생한다.
의료기기 사전허가(PMA) 신청 비용은 지난해 대비 9201달러 상승한 37만4858달러(약4억4000만원), 사전신고(510(K)) 신청 비용은 313달러 상승한 1만2745달러(약 1500만원)가 됐다.
한국바이오협회는 의약품 및 의료기기는 시장 출시 전 여러단계의 공급사슬을 거치고 관련 인허가 규제 업무가 복잡해지고 있기 때문에 규제기관의 심사수수료는 증가하는 추세라고 설명한다.
한국의 경우 신약 품목허가 신청비용은 803만1000원, 의료기기 제조/수입 허가신청 비용은 149만5000원으로 미국에 비해 각각 0.22%, 0.34% 수준이다.
▲한국바이오협회 보고서 자료



















