국제
인텔리아, 'in vivo CRISPR' 1상 중간 “장기 안전성·효능”
바이오스펙테이터 서윤석 기자
in vivo CRISPR 후보물질 ‘NTLA-2001’..0.3mg/kg 이상 투여군서 TTR 단백질 80% 감소 및 6개월 이상 감소효과 지속..안전성 문제 없어

인텔리아(Intellia Therapeutics)가 첫 in vivo CRISPR 후보물질의 ATTR 아밀로이드성 말초신경병증(ATTR-PN) 임상 1상에서 12개월간의 장기추적에서 안전성과 TTR 단백질 감소효과를 확인했다. 인체 내에서 직접 작용하는 유전자편집 약물인 ‘NTLA-2001’의 장기 안전성을 보여주는 첫 데이터다.
인텔리아와 리제네론은 24일(현지시간) in vivo CRISPR 후보물질 NTLA-2001의 ATTR-PN 임상 1상(NCT04601051) 중간분석(interim data) 결과를 발표했다.
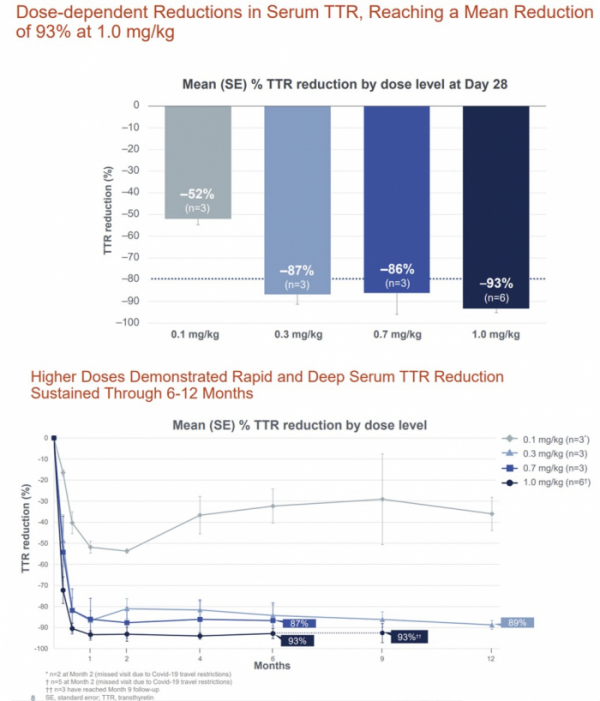
발표에 따르면 인텔리아는 임상 1상에서 ATTR-PN 환자 15명을 대상으로 NTLA-2001을 용량증량방식으로 투여해 혈중 TTR 단백질 수치의 지속적인 감소와 안전성을 확인했다. 구체적으로 인텔리아는 NTLA-2001 용량에 따라 0.1 mg/kg(3명), 0.3 mg/kg(3명), 0.7 mg/kg(3명), 1.0 mg/kg(6명) 등 4개 코호트로 나눠 1회 정맥투여 후 최대 24개월간 기준선 대비 혈액 내 TTR 단백질 변화와 안전성 등을 평가하고 있다.
그 결과 0.1mg/kg, 0.3mg/kg 투여군은 12개월차 분석에서, 0.7mg/kg, 1.0mg/kg 투여군은 6개월차 분석에서 혈액 내 TTR 단백질이 감소된 상태로 유지된 결과를 보였다. 먼저, 최고용량의 NTLA-2001 투여군(1.0mg/kg)은 치료 후 28일차에 ATTR 단백질 수치가 93%~98% 감소했으며, 6개월간 평균 93% 감소한 결과를 보였다. 0.7mg 용량의 NTLA-2001 투여군은 28일차에 TTR 단백질 수치가 평균 86% 감소했으며, 6개월차 분석까지 TTR 수치 감소가 유지됐다.
0.1mg/kg, 0.3mg/kg 투여군은 12개월차 분석시점까지 TTR 단백질 수치가 감소된 채로 유지되고 있었다. 특히 0.3mg/kg 투여군은 12개월차 분석에서 TTR 단백질 수치가 평균 89% 감소했다.
임상과정에서 나타난 대부분의 이상반응은 경미했으며 환자의 73%(11명)이 최대 1등급 이상반응을 나타냈다. 가장 빈번한 이상 반응은 두통, 주사관련반응(infusion-related reactions), 요통, 발진, 메스꺼움 등이었다. 모든 주사관련반응은 경증으로 임상적인 후유증없이 해결됐다. 위마비 병력을 가진 1.0 mg/kg 용량의 NTLA-2001 투여군 환자 1명에게서 3등급 구토(vomiting)가 보고됐다.
인텔리아의 NTLA-2001은 CRISPR/Cas9을 이용해 비정상적인 TTR 유전자를 제거해(Knock-out) TTR 단백질의 합성을 막아 치료하는 기전이다. 인텔리아는 지난 2016년부터 리제네론(Regeneron Pharmaceuticals)과 파트너십을 체결하고 NTLA-2001을 포함한 in vivo CRISPR 약물들을 공동개발하고 있다.
ATTR 아밀로이드증은 트랜스티레틴 유전자(TTR gene) 돌연변이로 인해 TTR 단백질이 잘못접힌(misfolding) 구조로 합성되어 발병한다. 비정상 TTR 단백질은 체내 아밀로이드의 축적을 유도해 심장, 신경계, 소화계 등 조직에 심각한 합병증을 유발한다.
존 레오나르드(John Leonard) 인텔리아 CEO는 “오늘 발표된 중간데이터를 기반으로 ATTR 아밀로이등 환자에게 NTLA-2001의 잠재력이 더 명확해지고 있다고 믿는다”며 “지금까지 확인된 안전성, 혈액내 TTR 감소 수치 등은 단일 투여 후 질병을 치료할 수 있는 가능성을 보여준다”고 말했다. 그는 “in vivo 유전자 편집치료제의 성공가능성을 보여주고 있으며, 최초로 전신투여된 in vivo CRISPR 치료제로 임상이 성공적으로 진행되길 기대한다”고 덧붙였다.
조지 얀코풀로스(George Yancopoulos) 리제네론 최고과학책임자는 “NTLA-2001의 안전성과 내약성 프로파일을 업데이트하게 되어 기쁘다”며 “단일 용량의 in vivo 유전자편집 약물은 치료하기 어려웠던 다양한 유전질환 환자들에게 적용이 가능하고 가장 흥미로운 의학적 돌파구 중 하나가 될 것”이라고 말했다.
인텔리아는 ATTR 심근병증(ATTR-CM) 환자를 대상으로 NTLA-2001의 임상 1상도 진행하고 있다. 인텔리아와 리제네론은 올해 하반기 ATTR-CM 임상 1상 중간결과를 발표할 계획이다.
한편 앨라일람(Alnylam Pharmaceuticals)은 지난 16일 TTR RNAi ‘암부트라(Amvuttra, vutrisiran)’를 ATTR-PN 치료제로 미국 식품의약국(FDA)로부터 승인받았다. 경쟁약물로는 아스트라제네카(AZ)와 아이오니스(Ionis Pharmaceuticals)가 개발 중인 ASO 후보물질 ‘에플론터센(Eplontersen)’이 있다.
기존 약물인 앨라일람의 '온파트로(Onpattro)'와 비교해 암부트라와 에플론터센은 각각 투여기간을 3주에서 3개월로 늘리거나, 정맥주사(IV) 제형을 피하주사(SC) 제형으로 바꿔 투약 편의성을 높였다. 현재 개발 중인 in vivo 유전자편집 약물은 1회 투여방식으로 치료가 가능한 장점을 가진다.
(인텔리아 발표 자료)















