기업
임상 안전관리시스템 가동..'중복참여자 실시간 확인'
바이오스펙테이터 천승현 기자
식약처, 임상시험 안전관리시스템 운영..중대 이상반응 등 신속 보고체계 구축
식품의약품안전처는 임상시험대상자의 안전관리를 강화하기 위해 ‘임상시험 안전관리시스템’을 구축하고 본격 운영한다고 9일 밝혔다.
임상시험에 참여하는 대상자가 단기간 내 다른 임상시험에 중복 참여할 수 없도록 시험대상자의 안전을 확보하고, 임상시험 실시기관의 임상시험 관련 보고의 편의성을 높이기 위해 마련됐다.
이 시스템의 주요 내용을 보면 임상시험실시기관이 임상시험 실시 전 안전관리시스템에 직접 접속해 임상시험에 참여하려는 대상자가 3개월 내 다른 임상시험에 중복 참여했는지를 확인할 수 있게 된다.
지금까지는 임상시험실시기관이 이메일 등으로 시험 참여 예정자를 식약처에 보고하면 중복 참여 여부를 확인하고 임상시험실시기관에 통보했지만 앞으로는 번거로운 절차를 거치지 않고도 실시간으로 임상시험 대상자의 중복 참여 여부를 파악할 수 있다.
임상시험실시기관 등이 임상시험 중에 나타날 수 있는 ‘예상하지 못한 중대한 약물이상반응(SUSAR)’은 그동안 문서로만 식약처에 보고하였으나, 이번 개발된 시스템으로도 정확하고 신속하게 보고할 수 있다.
임상시험 의뢰자·실시기관이 매년 2월 문서로 보고하던 임상시험 진행상황, 종료 등의 ‘임상시험 실시상황’은 ‘임상시험 안전관리시스템’이나 문서로 보고할 수 있게 된다.
식약처 관계자는 "이번 시스템 도입을 통해 임상시험 대상자에 대한 안전관리가 더욱 체계적으로 이루어 질 것이라며, 앞으로도 임상시험 안전관리 강화를 위해 더욱 노력하겠다"고 말했다. 해당 시스템은 의약품/화장품 전자민원창구(ezdrug.mfds.go.kr) → 보고마당→ 임상보고에서 확인할 수 있다.
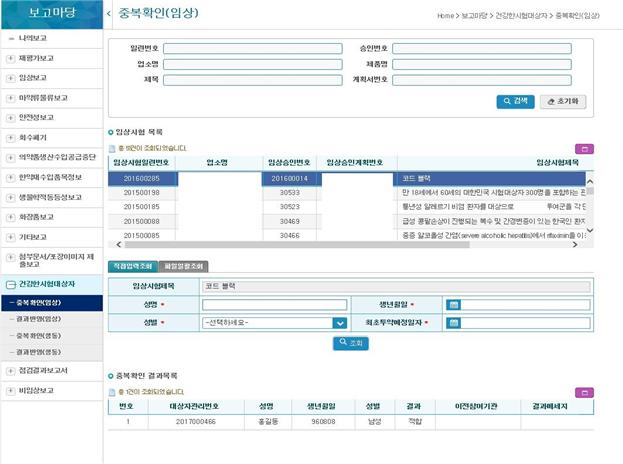
▲임상시험 안전관리시스템에서 상시험 대상자 중복 참여 여부 확인 절차(자료: 식품의약품안전처)



















