기업
한국 복제약 시장은 ‘노장 전성시대’..왜?
바이오스펙테이터 천승현 기자
제네릭 상위제품 처방실적 분석..발매 10년 안팎 제품들 대거 포진ㆍ경쟁심화 등으로 신제품 활약 미미
국내 복제약(제네릭) 시장에서 발매 이후 10년이 훌쩍 지난 ‘노장' 제품들이 전체 판도를 주도하고 있다. 합성의약품 제네릭 분야에서 새롭게 두각을 나타내는 제품을 찾아보기 힘든 실정이다. 제네릭 시장의 경쟁 심화로 특정 제품이 시장을 장악하는 현상이 사라지는 추세다.
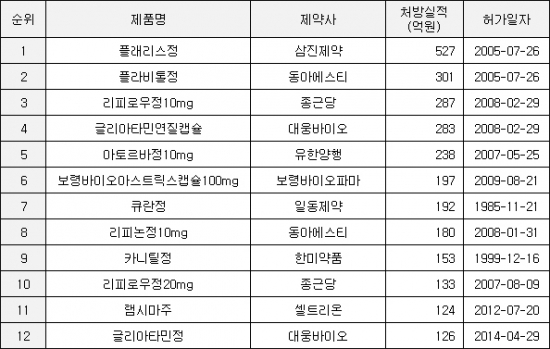
15일 국회가 건강보험심사평가원에 제출한 의약품 처방실적 자료에 따르면 지난해 국내 시장에서 제네릭 의약품 중 삼진제약의 ‘플래리스’가 가장 많은 527억원의 처방실적을 기록했다.
▲삼진제약 '플래리스'
플래리스는 ‘클로피도그렐’ 성분의 항혈전제로 오리지널 의약품은 사노피아벤티스의 ‘플라빅스’다. 플래리스는 2012년 412억원, 2013년 412억원, 2014년 439억원, 2015년 479억원 등에 이어 5년 연속 제네릭 처방실적 1위를 지속했다.
지난 2011년에는 동아에스티의 ‘플라비톨’이 458억원의 처방실적으로 제네릭 1위에 오른 바 있다. 지난해 플라비톨은 301억원어치 처방되며 5년 전보다 34.3% 줄었지만 제네릭 2위 자리는 유지했다.
종근당의 고지혈증치료제 ‘리피로우10mg'이 287억원의 처방실적을 기록하며 뒤를 이었다. 리피로우는 화이자의 ’리피토‘과 같은 ’아토르바스타틴‘ 성분의 제네릭이다. 리피로우의 경우 20mg(133억원)과 함께 420억원을 합작하며 선두권을 바짝 추격했다.
▲2016년 주요 복제약 제품 처방실적 추이(단위: 억원, 자료: 건강보험심사평가원)
대웅바이오의 뇌기능개선제 ‘글리아타민’(283억원), 유한양행의 고지혈증치료제 ‘아토르바10mg'(238억원), 보령바이오파마의 ’보령바이오아스트릭스‘(197억원) 등이 200억원 안팎의 처방실적으로 제네릭 시장을 주도했다.
▲셀트리온 '램시마'
바이오의약품에서는 ‘레미케이드’의 바이오시밀러 ‘램시마’가 124억원의 처방실적으로 전체 11위에 랭크됐다는 점이 눈에 띈다. 지난 2012년 ‘세계 첫 항체 바이오시밀러’라는 타이틀을 달고 국내 허가를 받은 램시마는 2014년 60억, 2015년 91억원에 이어 매년 가파른 상승세를 지속했다.
제네릭 의약품 상위권에 포진한 제품을 보면 램시마를 제외하고 2010년 이전에 발매된 ‘노장’ 제품이라는 공통점이 있다. 글리아타민과 보령바이오아스트릭스의 경우 상대적으로 최근에 허가받았지만 각각 대웅제약 ‘글리아티린’, 보령제약 ‘아스트릭스’의 후속제품 성격이 짙다는 사실을 감안하면 신제품으로 분류하기는 어렵다.
제네릭 처방실적 상위 10개 중 6개를 배출한 오리지널 의약품 플라빅스와 리피토는 각각 2007년과 2008년 특허가 만료돼 제네릭이 발매된 시장이다. 최근 신약의 특허가 만료돼 새롭게 열린 제네릭 시장에서는 전체 판도를 주도할만한 굵직한 제품이 등장하지 않는다는 의미다.
2010년 이후에도 대형 제네릭 시장은 매년 지속적으로 개방됐지만 좀처럼 오리지널 의약품을 위협하는 제품은 등장하지 않는다.
지난 2014년 고지혈증치료제 ‘크레스토’의 특허가 만료되자 무려 111개(10mg 기준)의 제네릭이 침투했다. 일동제약의 ‘로베틴10mg'(65억원), 보령제약의 ’크레산트10mg'(48억원), 종근당의 ‘로수로드10mg'(46억원) 등이 선두권을 형성하고 있지만 100억원 이상의 제품은 배출하지 못하고 있다. 지난해 크레스토10mg은 485억원어치 처방되며 여전히 제네릭 제품들과 큰 격차를 유지했다.
화이자의 소염진통제 ‘쎄레브렉스’(2015년), 대웅제약의 고혈압치료제 ‘올메텍’(2013년), BMS의 B형간염치료제 ‘바라크루드’(2015년 특허만료), 동아에스티의 위염치료제 ‘스티렌’(2015년 특허만료), 노바티스의 고혈압치료제 ‘엑스포지’(2013년) 등 대형 제품들이 속속 제네릭 시장이 개방됐지만 연간 처방실적 50억원 이상을 올리는 제네릭은 전무하다. 제네릭 제품들간 한정된 시장에서 ‘나눠먹기’ 경쟁을 펼치고 있다는 의미다.
제네릭 시장의 과열경쟁이 굵직한 제네릭의 등장을 어렵게 하는 요인으로 지목된다. 바라크루도0.5mg의 경우 65개의 제네릭이 발매됐고, 엑스포지5/80mg은 108개의 제네릭이 건강보험 급여목록에 등재된 상태다. 쎄레브렉스200mg와 스티렌의 제네릭은 각각 104개, 88개나 발매됐다.
제네릭의 시장 진입 장벽이 과거에 비해 낮아져 경쟁이 심화한 것으로 분석된다.
지난 2011년 11월 공동 생동 규제가 폐지된 이후 다른 업체에서 제네릭을 생산해 허가받는 ‘위탁 제네릭’이 크게 늘었다. 지난 2014년에는 위탁 의약품의 허가시 허가용 의약품을 의무적으로 생산해야 하는 규정이 큰 폭으로 완화됐다. 기존에는 다른 업체가 대신 생산해주는 위탁 의약품이 허가를 받으려면 3개 제조단위(3배치)를 미리 생산해야 했지만 GMP적합판정을 통과한 제조시설에서 생산 중인 제네릭을 제품명과 포장만 바꿔 허가받을 때 허가용 의약품 생산을 생략해도 된다.
최근 전문 영업 대행 업체(CSO, Contract Sales Organization)를 활용한 제네릭 영업도 활성화되면서 시장 경쟁은 더욱 과열되고 있다는 지적이 나온다. CSO는 제약사가 일정 비용을 지불하고 특정 제품의 영업을 전담하는 업체다. 주로 제약사 영업사원 출신으로 구성됐다. 신생 업체를 중심으로 영업조직을 구축하지 않고 CSO를 활용한 제네릭 영업을 진행하면서 경쟁 심화를 부추긴다는 우려가 제기된다.
업계 한 관계자는 “최근에는 신약의 판매를 국내제약사들도 공동으로 진행하면서 제네릭 제품이 좀처럼 시장을 잠식하기 힘든 여건이다. 리베이트 규제 강화로 적극적인 영업을 펼칠 수도 없어 제네릭의 입지가 점차적으로 좁아지는 상황이다”라고 토로했다.


















