기업
한미, 얀센 기술수출 신약 하반기 임상 재개..'생산지연 해결'
바이오스펙테이터 천승현 기자
FDA에 임상1상시험 신청ㆍ생산지연으로 중단한 임상 조기종료..한미 "랩스커버리 생산 지연 이슈 해소"

▲한미약품 연구센터 전경
한미약품이 얀센에 기술수출한 당뇨·비만치료제 ‘JNJ-64565111’의 임상시험이 하반기에 재개된다. 한미약품 측은 “랩스커버리 적용 의약품의 생산 지연 문제가 해결됐다”는 입장이다.
9일 한미약품에 따르면 얀센은 JNJ-64565111(한미 과제명 HM12525A)의 새로운 임상1상시험을 시작하기 위해 미국 식품의약품국(FDA)에 임상 허가를 신청했다. 제2형 당뇨병 환자에서 JNJ-64565111의 안전성, 내약성, 약물 동력학 및 약력학 평가를 위한 임상 1상시험이다.
얀센은 지난해 말 중단했던 임상1상시험은 조기 종료했다. 얀센은 최근 국제 임상시험 등록사이트 ‘Clinical Trials'에 JNJ-64565111의 개발 진행 과정을 'suspended participant recruitment’(환자 모집 유예)에서 'Terminated'(종료)로 변경했다.
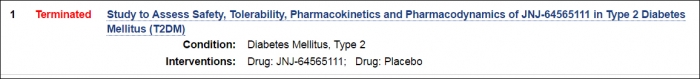
▲얀센은 최근 국제 임상시험 등록사이트 ‘Clinical Trials'에 JNJ-64565111의 개발 진행 과정을 'suspended participant recruitment’(환자 모집 유예)에서 'Terminated'(종료)로 변경했다.
앞서 얀센은 지난해 11월말 임상1상시험이 진행 중이던 JNJ-64565111의 개발 진행 과정을 ‘recruiting’(환자모집)에서 ‘suspended participant recruitment’(환자 모집 유예)로 변경했다. 임상시험용 약물 생산 지연으로 임상시험 일정에 차질이 빚게 된 것이다.
‘JNJ-64565111’는 지난해 11월 한미약품이 얀센에 기술수출한 지속형 당뇨·비만치료제 HM12525A의 과제명이다. 기존에 존재하는 두 개의 성분을 한미약품이 보유한 약효지속 기반기술 랩스커버리(LAPSCOVERY)를 적용한 바이오신약이다.
한미약품은 주 1회 투약 가능한 당뇨ㆍ비만치료제로 개발하기 위해 임상1상시험을 마치고 얀센에 기술수출했다. 랩스커버리는 바이오의약품의 짧은 반감기를 늘려주는 플랫폼 기술로 투여 횟수 및 투여량을 감소시켜 부작용은 줄이고 효능은 개선하는 기술이다.
한미약품 측은 “JNJ-64565111의 임상시험용 의약품의 생산 관련 지연(manufacturing-related delay) 이슈가 해소됐다”라고 설명했다.
얀센도 임상용 의약품 생산 재개를 확인하고 하반기에 동일한 물질로 타깃시장에 맞는 환자군과 용량을 적용한 새로운 임상1상시험에 돌입키로 했다는 설명이다. 다만 기존에 진행하던 임상시험은 중단한지 6개월 이상 지났기 때문에 기존 임상시험을 이어서 하는 것보다는 새롭게 설계된 임상시험을 선택한 것으로 관측된다.
한미약품이 2015년 사노피에 기술수출한 이후 임상시험이 지연됐던 당뇨약 '에페글레나타이'도는 오는 4분기에 임상3상시험을 시작한다고 지난달 사노피가 밝힌 바 있다.
한미약품 관계자는 “이전의 임상1상시험에서 JNJ-64565111의 안전성을 확인했다”면서 “양사간 계약사항은 변동이 없다”고 말했다.



















