오피니언
암 조기진단 위한 '액체생검'의 거침없는 도전
김태형 테라젠이텍스 이사
[바이오스펙테이터 창간1주념 기고⑧]김태형 테라젠이텍스 바이오연구소 이사

▲김태형 테라젠이텍스 바이오연구소 이사(수석연구원)
액체생검(Liquid Biopsy)은 혈액 속에서 극미량의 암 세포 DNA를 찾아 암을 스크리닝 하는 기술로 최근 2년 사이에 이 기술을 기반으로 한 '조기 종양 검사(early cancer detection)' 회사들의 투자 소식과 그들의 연구결과 발표가 끊이지 않으며 핫이슈로 떠오르고 있다.
사실 이들 기술의 가능성에 대한 정확한 팩트는 작년 말부터 시작되는 대규모 종단 임상 (longitudinal study)연구들이 끝나는 앞으로 5년 이후에나 정확히 알 수 있겠지만 최근 '조기 종양 검사 서비스' 관련 자료를 조사하면서 알게 된 내용 중에 대표적인 기업인 그레일(GRAIL)에 대한 정보들을 공유해보고자 한다.
미국임상암학회로 부터 전해 온 그레일 소식
지난 6월 5일 미국임상암학회(ASCO Annual Meeting 2017)에서 그레일(GRAIL)은 처음으로 본인들이 개발한 혈액 내 존재하는 암 유전체를 분석하는 기술을 공개했고 그 가능성을 일부 확인할 수 있었다. 이러한 기술을 액체생검(Liquid Biopsy)이라고 하며 조직생검(Tissue biopsy)의 환자의 불편함을 극복하고 지속적인 확인이 가능해 대안으로 제시되고 있다.
이 발표는 메모리얼 슬론 케터링 암 센터(MSKCC)의 공동연구자인 라자비(Razavi) 박사와 함께 했다. 그레일의 예상된 여러가지 기술 중에 미국 임상암학회 발표로 확인된 3가지는 다음과 같다.

▲ASCO 2017 GRAIL’s Poster
1. 울트라 딥 시퀀싱 (Ultra deep sequencing) 기술.
2. 분자 바코딩 (molecular barcoding)을 통한 오류 교정(error correction) 실험 및 생명정보 분석 기술.
3. 백혈구 유전체에서 유래된 변이들을 제거하는 생명정보 분석 기술.
* 울트라 딥 시퀀싱: 이번 발표에서 보면 그레일은 NGS 기반의 유전자 패널 검사 시 >500배 정도 시퀀싱 하는 것에 비해, 혈액에서 떠돌아다니는 극미량 암변이를 발견하기 위해 >60,000배까지 시퀀싱 한것을 볼 수 있었다.
미국임상암학회에서 발표한 2개 연구결과를 요약하면..
하나는 124명의 말기 암환자들을 대상으로 같은 환자에서 유래된 혈액/종양조직 샘플을 동시에 얻었다. 종양 조직은 MSK-IMPACT 유전자 패널을 이용해 시퀀싱 및 분석하고 혈액은 그레일의 패널을 이용해 각각 분석한 뒤 맹검시험(blind test)을 진행하였다.
그 결과 혈액/종양조직 샘플에서 나온 체세포변이(somatic mutation)들이 참여한 환자중에 89%가 일치 된다는 것을 확인했다. 그리고 종양조직에서 낮은 빈도/ 높은 빈도로 발견된 다양한 체세포 변이 864개 중에 약 627개인 73%의 변이가 환자의 혈액에서 나온 결과와 같았다고 한다.
* MSK-IMPACT 유전자 패널 : 410개 유전자, 1.4 Mb, >500X depth, 700MB
* 그레일의 패널: 508개 유전자, 2 Mb; >60,000X, 120GB
또 다른 연구 결과 발표도 있었는데 개인적으로는 이 연구에 더 흥미가 갔다. 암환자가 아닌 건강한 사람 47명에게서 암 발생의 원인이 아닌 세포 노화의 원인(Age-related somatic mutations)으로 발생한 체세포 변이가 빈번하게 존재 한다는 것을 알게 되었다는 것이다.
건강한 사람의 혈액을 통해 암이 발생하기 전에 이를 찾아내는 구체적인 기술들에 대해서는 아직까진 제대로 보고된 것이 없지만 ASCO에서 선보인 중간 임상연구 결과들을 보았을 때 다음 임상시험 연구 결과 발표도 어느 정도는 긍정적인 결과가 있을 것으로 예상된다.
그레일의 최대 규모 조기 암 스크리닝 임상 시험 연구(CCGA와 STRIVE 스터디)
첫번째로 작넌 12월에 처음으로 계획되고 발표된 Cell-Free Genome Atlas(CCGA) 스터디는 최소 5년간 암환자 7000명, 건강인 3000명을 대상으로 디자인된 대규모 임상시험이다.
또 다른 대규모 임상시험으로는 STRIVE가 있는데 임상시험 대상은 '메이오 클리닉(Mayo Clinic)'과 '셔틀헬스시스템(Sutter Health system)'에 방문해 '맘모그램 스크리닝(mammograms)' 루틴 검사를 받는 12만명의 45세 이상 중년 여성을 대상으로 참여 시킬 계획이며 목적은 조기에 유방암을 검출하기 위한 기술을 개발하고 검증하기 위해 디자인되었다.
암통계학적으로 보면 이 임상시험을 통해 올해만 650명의 여성이 유방암이 발생할것으로 예상되며 미리 저장된 혈액의 플라스마를 분석해 암을 정확하게 예측하는 DNA 검사 개발과 검증에 활용될 것으로 보인다.
그레일의 기술은 기존의 전통적인 방식(PCR 기반)과는 다르게 NGS 기반 기술을 이용해 아주 넓은(ultra-wide) 유전자 영역을 해독/분석하는 울트라딥(ultra-deep)시퀀싱 방식을 이용한다. 이 방법은 고강도(high-intensity)로 혈액 튜브에 있는 적은 플라즈마 종양 DNA(ptDNA 또는 ctDNA)에도 민감하게 반응할 필요가 있다. 그리고 이를 검출해내기 위해선 단 한 명의 혈액을 검사함에도 수십 기가바이트(Gb)에서 테라바이트(Tb) 수준으로 시퀀싱 데이터를 생산해야 할 수도 있다.
그레일의 임상시험 전략은 극명하게 차별화 된다. NGS 기반으로 ctDNA를 분석하는 회사들인 파운데이션메디슨(Foundation Medicine), 로슈(Roche), 가던트 헬스케어(Guardant Health)등과 같은 회사들은 조기 암 검진을 위해서 극복해야할 숙제가 많아 처음에는 암환자를 대상으로 혈액 검사 서비스를 수행 하다가 충분한 기술과 임상경험을 확보한 이후 조기 암 스크리닝 기술 개발로 방향을 잡아가려는 전략과는 달리 그레일은 곧장 베이스캠프(암환자 대상 검사)도 거치지 않고 에베레스트 산의 정상(건강인 대상 검사)으로 나아가는 전략이다. 이에 전문가들 사이에서도 그레일의 행보와 자신감에 적잖게 놀라고 한편으로는 너무 성급한것은 아닌가 하는 우려를 하고 있다.
아마도 그레일은 후발 주자로서의 핸디캡을 극복하고 다른 경쟁자보다 빠르게 건강인을 대상으로한 종양 검사를 실현하기 위해 엄청난 규모의 고위험도 무증상(asymptomatic) 참여자를 대상으로한 종단임상연구를 통해 이후 암을 진단 받은 대규모 샘플을 확보하려는 것으로 보인다.
그레일은 이런 대규모 임상을 할수 있기 위해 진단 비즈니스 역사상 가장 큰 규모의 투자를 유치했다. 2016년에 일루미나가 빌게이츠와 베조스를 통해 1억달러를 투자 받았으며 2017년 3월 1일에 그레일은 시리즈 B 투자로 ARCH 벤처 파트너스와 존슨앤드존슨으로부터 9억 달러 이상을 투자 받아 총 10억 달러가 넘는 투자금을 확보했다.
이를 통해 투자금의 일부를 사용해 일루미나가 보유한 그레일의 주식 대부분을 사들였으며 현재 일루미나는 그레일의 지분에 있어 20% 미만 수준에 불과해 공식적으로는 더 이상 그레일은 일루미나의 자회사는 아니게 되었다.
이러한 추세를 감안했을 때 그레일의 액체생검 기술을 이용한 건강인을 대상으로 한 첫 암 조기 진단 서비스는 임상시험이 끝나는 5년 이후가 아닌 몇 년을 앞당겨 늦어도 2020년 전에 이뤄질것으로 예상 되고 있다.
그레일은 액체생검의 끝판왕으로 등극할것인가?
지난 5월 말에 그레일은 시리나(Cirina)라는 회사를 합병을 공식적으로 발표했다.
시리나는 '데니스 로(Dennis Lo)'가 2014년에 설립한 회사이며 그는 1997년 비침습적 태아 기형아 검사(NIPT)를 세계 최초로 발표하 과학자로써 지금은 한해 전세계적으로 백만명 이상의 임산부들이 이 서비스를 받고 있다.

▲Dennis Lo
왜 그레일이 데니스 로의 시리나를 합병하겠다고 했을까? 이유는 두 가지로 볼 수 있다.
첫 번째는 시장 규모가 가장 큰 수십억 인구의 아시아에 진입하기 위한 교두보를 확보하기 위해서이다.
두 번째는 시리나는 혈액에서 암을 진단하는 핵심 기술을 가진 회사이기 때문이다.
시리나의 최근 발표에 따르면 헤파타이티스 B 바이러스(Hepatitis B virus)또는 엡스타인바 바이러스(Epstein-Barr virus)에 감염된 고위험군을 대상으로 임상연구를 진행했으며, 임상 참여자 혈액의 플라즈마에 떠 다니는 죽은 암세포에서 유래된 바이러스 DNA를 정확하게 검출할수 있는 기술을 이미 확보한것으로 보인다.
게다가 데니스 로의 최근 연구 내용들을 보면 메틸레이션(methylation) 분석기술에 집중하고 있는데 혈중 종양 DNA(ctDNA)만 가지고도 어떤 조직에서 암이 유래되었는지 알수 있는 획기적인 기술을 보유하고 있는것으로 보인다.
조기 암 검출을 위한 새로운 최첨단 액체생검 기술 개발에 있어 전세겨가 경쟁이 치열하게 진행되는 상황에서 이미 확보한 막대한 자금력에 더해 그레일의 시리나 합병은 아시아의 진출을 위한 교두보 확보와 함께 기술적 경쟁우위를 차지해 두마리 토끼를 다 잡아 신의 한 수로 평가 받을 만 하다.
그러나 난관은 분명히 존재한다. 중국 내 게놈 사업을 글로벌 수준으로 성장시키기 위한 중국 정부의 보호장벽을 뚫는 것이 그리 쉽지 만은 않을 것으로 보인다.
보겔슈타인, 미국 암학회 조기 암 스크리닝 관련 발표
올해 2017년 4월 초에 있었던 미국암학회 기조강연 중 p53 유전자를 발견해 유명한 존스홉킨스의 보겔슈타인(Bert Vogelstein, MD)박사의 '조기 암 검출(Eearly cancer detection)'에 관한 발표가 있었다.
워싱턴 D.C. 컨벤션 센터에서 보겔슈타인의 강연을 직접 보게 되었는데 항상 큰 비젼을 제시하고 젊은 과학들에게는 롤모델이 되는 분이라서 그런지 기대도 컸고 기대에 부응하는 강력한 메세지를 우리에게 전달했다.
보겔슈타인은 다음 세대의 암 치료 혁신은 '치료와 예방'이 결합된 방식이 될것이라고 말하면서 강연을 시작했다. 그러면서 가장 먼저 멜라노마 환자에서 '베무라페님 내성(Vemurafenib resistance)'에 관한 유명한 사진을 보여주면서 항암제 내성의 근본적인 문제는 이미 항암제 치료 전부터 항암제 내성 세포가 수백~수천개의 존재하고 있어 항암제 처방은 본의 아니게 선택적인 강한 압박을 통해 다른 암 세포들을 제거해 내성 세포들이 새로운 암세포로 재생할수 있게 새로운 환경을 만들어주게 된다고 말했다.
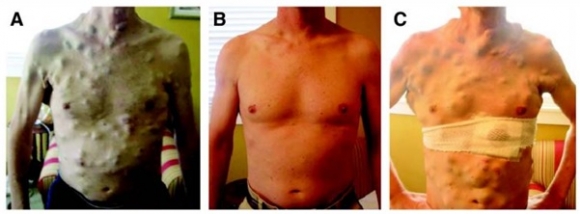
▲J Clin Oncol. 2011 Aug 1; 29(22): 3085–3096.
또한 이들 내성 세포가 생기기 전인 초기 단계의 종양세포가 적게 존재하는 작은 종양인 1mm 정도 사이즈면 대부분 완치 가능하다고 한다. 그래서 그는 “조기 암 진단은 사람의 종양을 마우스의 종양 처럼 작게 만드는 효과가 있다”라는 의미심장한 말을 던졌다. 마우스를 이용해 항암제 치료 실험을 해보면 치료 효과가 좋은데 그 이유는 마우스에서 발생하는 종양은 기본적으로 사람의 종양보다 1,000배 작기 때문이라고 한다.
그 만큼 다양한 암 돌연변이가 생길 가능성이 매우 낮고 내성 세포가 생길 가능성이 거의 없기 때문이라는 것이다.
암 진행에 따른 생존률을 봐도 암 4기의 암생존률은 11% 밖에 안되지만 암 1기는 생존률이 94%로 매우 높은 것을 봐도 초기에 발견하는 것이 매우 중요하다는 것을 확인시켜 준다.
그리고 모든 생물은 노화가 진행됨에 따라 암에 노출될 가능성도 같이 높아지게 되는데..
존스홉킨스의 '토마세띠(Tomasetti)' 의해 언급된 것처럼 암 돌연변이가 발생하는 주요 원인으로는 유전적, 환경적, 그리고 세포복제가 있는데 그 중에서도 65% 이상이 세포복제의 원인으로 발생한다는 것이다.
세포가 복제를 많이 하면 할수록 랜덤 변이가 누적된다는 것인데 실제로 정상 세포에서도 세포분열시 게놈 복제 에러가 일어나고 그로 인해 1-2개의 랜덤 체세포 DNA 변이가 수리(repair)가 되지 않은 체 세포 내에 누적되며 연간 평균 약 40개 체세포 변이가, 세포가 죽기 전까지 약 50~1,000개의 체세포 변이가 누적되게 된다고 한다.
암은 사람이 늙어감에 따라 당연하게 발생하는 질병으로 이를 조기에 암을 검출하고 이를 치료할수 있는 치료제 개발이 우선돼야 한다.
그러려면 기존 액체생검 스크리닝 검사를 이용한 초기 암의 진단에 있어 30% 민감도(sensitivity)를 100%까지 끌어 올릴 필요가 있으며 이를 위해 체세포변이, DNA 메틸레이션, 전사체(mRNA, siRNA), 단백질, 대사체 마커들을 복합적으로 적용하는 기술을 개발해 민감도가 높은 검출 방법을 개발할 필요가 있다.
본인이 근무하고 있는 테라젠이텍스 바이오 연구소에서도 높은 민감도와 정확도를 갖는 암 돌연변이 검출기술을 확보하였으며 이와 더불어 다양한 액체생검 기술을 조합해 혈액 내 존재하는 극미량의 암 돌연변이를 높은 민감도로 정확하게 찾아내기 위한 파일럿 스터디를 진행중에 있으며 초기 암환자 또는 고위험(암) 참여자를 대상으로한 대규모 종단 임상시험을 진행할 예정이다.
끝으로
통계자료에 따르면 1960년 이후에 태어난 사람들은 수명이 늘어나 암이 발생할 가능성도 높아져 각 개인이 평생동안 암에 걸릴 가능성도 50%까지 높아졌다.
최근 2년 동안 급속도로 발전하고 있는 액체 생검 검사 서비스 시장 규모는 2020년까지 연간 약 5조원 정도 될것으로 예측한다. 당분간은 액체생검 서비스는 주로 전립선암, 대장암, 폐암, 유방암 중심으로 적용되어 진행될 가능성이 높아 보이며 곧 이어 모든 암으로 확장되어 서비스가 될것으로 기대된다.
또한 본격적으로 조기 암 검진 검사가 실시되면 앞으로 암사망률을 45% 정도로 극적으로 낮출 수 있을것이라 보는 긍정적인 견해의 전문가 의견도 있다.
하지만 액체생검 기술은 아직 많은 한계가 있는 것도 분명한 사실이다. 최근 급속히 발전하고 있는 NGS 기반의 혈중 종양 검사의 경우 환자 당 대용량 시퀀싱 데이터를 생산하게 됨으로 인해 고비용의 검사비는 어쩔수 없어 보이며 메틸레이션, siRNA, 단백질, 대사체 마커들을 컴비네이션으로 여러 검사를 함께 수행하게 된다면 이로 인한 비용적인 부담은 더욱 더 높아질 것으로 보인다. (한편으로는 고가의 비침습적 태아 기형아 검사가 몇 년 사이에 절반 이하로 낮아짐과 같은 급격한 비용 절감이 일어날 것으로 보는 측면도 있다.)
게다가 무증상 사람들의 혈중에 떠 돌아 다니는 극미량의 암돌연변이를 검출하는 것은 매우 어려워 아직 성공한 사례가 많지않고 이러한 변이가 발견된다 하더라도 위양성(false positive)이거나 극소량 존재하는 종양 DNA 변이들을 전혀 검출하지 못해 위음성(false negative)과 같은 잘못된 결과들을 만들어 내는 경우가 더 많아 이러한 잘못된 결과들로 인해 환자나 임상의사에게는 패닉에 걸리게 할수가 있기 때문에 좀 더 많은 시간을 두고 기술 개발에 집중해 업그레이드가 필요하고 대규모 과학적 근거자료 확보가 필요로 해 보인다.















