기업
'허가불발' SK 과민성방광약 임상결과의 상반된 시선
바이오스펙테이터 이은아 기자
'부작용 발현 13%p 격차' 두고 식약처ㆍ임상연구진 엇갈린 평가..식약처 "안전성ㆍ유효성 타당X" vs 연구진 "약효 지속 개선ㆍ부작용 감소"
SK케미칼이 국내서 임상3상시험을 진행한 과민성방광치료제 'THDV-201'의 긍정적인 연구결과를 발표했다. 특히 동일한 연구결과를 두고 보건당국이 허가 불발 이유로 제시한 부작용 문제에 대해 연구진은 긍정적인 평가를 내렸다는 점에서 주목을 끈다.
THDV-201은 SK케미칼이 2013년 원개발사인 미국 테라비다와 국내 독점 판권 계약을 체결한 이후 국내에서 임상3상시험을 진행한 약물이다.
THDV-201은 기존 과민성방광치료제가 복용시 입마름 현상을 유발해 물 섭취가 필요하고 다시 소변량을 증가시켜 환자의 고통을 가중한다는 점에서 착안해 개발된 복합제다. 기존에 과민성방광 치료제로 사용되는 성분 '톨터로딘'과 침 분비를 촉진하는 '필로카르핀'을 결합한 복합제를 통해 과민성방광증후군과 입마름 현상을 동시에 치료하겠다는 취지로 개발됐다. 이 약물은 제제학적 기술로 톨터로딘으로 인한 구갈 발현 시점에 필로카르핀이 나중에 방출되도록 설계됐다.
SK케미칼은 THDV-201의 임상3상시험 결과를 토대로 국내 허가를 신청했지만 식약처 승인을 통과하지 못했다.
지난 8월 식품의약품안전처의 전문가 자문기구인 중앙약사심의위원회는 THDV-201에 대해 "임상적 유익성이 없어 복합제 허가가 타당하지 않다"라는 결론을 내렸다. 임상시험에서 복합제 복용시 입마름(구갈) 외 부작용 증가, 중도탈락자 증가, 임상1상 관찰된 약동학적 우려가 해소되지 않았다는 등의 이유에서다. 특별한 사유 없이는 식약처가 중앙약심의 권고를 수용하는 관행을 감안하면 현재로서는 THDV-201의 국내허가는 사실상 불발된 셈이다.
이런 상황에서 SK케미칼은 지난 9월 국내외 비뇨기학회에서 THDV-201 임상결과를 발표했다.
최근 서울 서초구 더케이호텔에서 열린 '제69차 대한비뇨기과학회 추계학술대회’에서 고광진 삼성서울병원 교수는 “3상 임상시험 결과 THVD-201을 12주 복용시 과민성방광치료 약효를 유지하면서 구갈 발현을 효과적으로 감소시켰다. 24주 장기 복용시에도 지속적인 약효 및 안전성을 확보했다”라고 발표했다.
◇12주간 복합제 복용시 약효 유지, 구갈 현상 감소
바이오스펙테이터는 최근 국내 ‘대한비뇨기과학회 추계 학술대회‘와 이탈리아 피렌체에서 열린 국제 배뇨장애·요실금 학회인 ‘ICS(International Continence Society) 2017’에서 공개한 12주(단기), 24주(장기) 과민성방광치료복합제 ’THDV-201‘ 임상 3상결과를 살펴봤다.
12주간 단기 THVD-201 임상시험 결과를 먼저 살펴보자. 임상시험은 하루 소변 횟수 8회 이상, 절박뇨(urgency episode) 2회 이상, 과민성 방광 증상 점수(OABSS)가 6점 이상인 환자를 대상으로 복합제인 톨터로딘/필로카르핀(2/9mg)(193명)과 대조군으로 톨터로딘(2mg)(191명) 단일제를 12주간 하루 2회 경구 투여했다.
임상시험에서 주요평가목표는 12주 후 치료 시작 전(baseline)으로부터 하루 소변 횟수 변화와 구갈 누적 발현빈도 값으로 설정했다.
대한비뇨기과학회에서 발표한 초록에 따르면 임상결과 투여 전(베이스라인)에 비해 12주차 하루 소변 횟수 변화는 복합제와 단일제 복용한 두 그룹간 유사했다. 단일제 대비 복합제의 비열등성을 입증한 것. 톨터로딘/필로카르핀 복합제 복용시 하루 소변 횟수 변화값은 -1.49±2.20이고 톨터로딘 단일제 복용시에는 -1.79±1.99 값으로 두 그룹간 차이가 -0.26±2.09였다. 이 값은 두 그룹간 차이에 대한 95% 양측 신뢰구간이 [-0.79, 0.27]로 하한치가 사전에 설정한 비열등성 한계인 -1.0회 이상이므로 복합제가 단일제 대비 비열등함을 확인한 것이다.
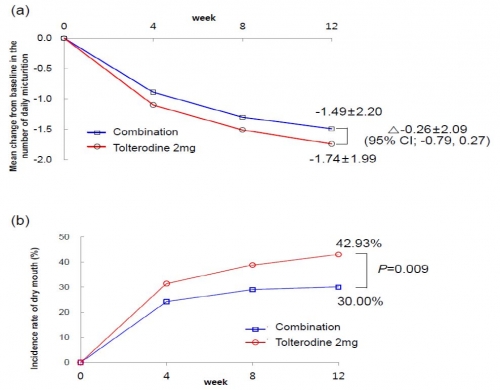
▲과민성방광치료복합제 'THVD-201'의 12주간 일차평가변수 (a)하루 소변 횟수 변화 (b)입마름(구갈) 발현 빈도 (자료제공: SK케미칼, 출처: 제 69차 대한비뇨기과학회 추계 학술대회 초록)
허가 보류의 원인으로 지목된 구갈 발현 빈도는 복합제 그룹이 단일제보다 낮았다. 12주째 복합제 그룹은 구갈발현 비율이 30%로, 단일제 그룹의 42.93%와 비교시 통계적으로 유의하게 감소했다. 다시말해 12주간 복합제 복용시 약효는 유지되고 구갈현상은 감소했다.
임상시험에서 2차 평가변수로 확인한 구강건조 평가지표인 VAS와 XI(xerostomia inventory total score) 값은 복합제 그룹이 단일제 그룹과 비교시 유의미하게 낮았다. VAS는 구강건조 증상에 대해, XI는 입마름 관련 불편함에 대해 주관적으로 느끼는 증상을 수치화한 평가방식이다. 점수가 낮을수록 건조하지 않고 입마름에 대한 불편함이 적다는 것을 의미한다. 구갈 외 다른 부작용은 두 그룹간 유사했다.
연구진은 “12주간 톨터로딘과 필로카르핀 복합제 복용시 과민성방광 치료 효능을 유지하면서 톨터로딘 단일제 대비 구갈 발생률도 효과적으로 감소시켰고 내약성도 양호했다”고 결론내렸다. 식약처가 의문을 품었던 구갈 발생에 대해 연구진은 긍정적인 평가를 내린 것이다.
지난 8월 이 약물의 허가 여부를 논의한 회의록을 보면 당시 중앙약심은 “복합제로 이익을 얻는 환자비율은 13%로 적기 때문에 비용 대비 효과가 낮은 것으로 판단되고, 복합제 복용시 구갈 현상이 일어나지 않은 57%는 필로카르핀 투여가 불필요하다”고 지적했다.
같은 수치의 부작용 데이터를 두고 연구진과 식약처는 상반된 시각을 드러낸 셈이다.
'30%'와 '43%'라는 복합제와 단일제의 구갈발현 부작용 비율 격차를 두고 임상시험을 수행한 연구진은 유의미한 개선으로 결론내렸다. 부작용 발현 비율이 43%에서 30%로 떨어진 것은 의미가 크다는 판단이다.
하지만 식약처는 '13%포인트'의 개선효과가 이 약물의 허가를 내주기에는 부족하다고 판단했다.
당시 중앙약심 회의에서 한 위원은 "단일제에서 구갈 발현한 43%가 복합제 복용시 30%로 13%(포인트) 줄었는데, 이를 뒤집어 보면 단일제 복용에도 구갈이 발현되지 않은 57%는 불필요하게 필로카르핀을 복용하는 것이 아닌가"라는 의문을 제기했다. 단일제 대비 복합제에서 부작용 비율이 낮아졌지만 여전히 30%의 발현율은 높은 수치라는 점을 문제 삼은 것으로 보인다.
중앙약심 회의에서 SK케미칼 측은 "해당 수치는 잘 통제된 환경에서 나온 값으로 통계적 유의성이 관찰돼 임상적 의미가 있다고 판단한다"라며 엇갈린 시각을 내비쳤다.
◇24주간 장기 복용시 과민성방광 치료효과 지속적 개선, 구갈 현상도 드라마틱한 감소
임상시험은 12주간 추가 연장해 24주간 장기 복합제 복용시 유효성과 안전성도 평가했다. 이때 이전에 12주간 복합제를 복용한 그룹 중 124명은 이후 12주간 복합제를 추가 투여하고, 앞서 12주간 단일제 복용한 그룹 중 132명이 이후 12주 동안 복합제로 바꿔 투여했다.
총 256명 환자를 대상으로 확장 임상시험한 결과 24주간 복합제를 장기 복용한 그룹(extended 그룹)은 단일제에서 복합제로 바꿔 복용한 그룹(changed 그룹) 모두 약효 개선효과가 확인됐다. 복용 24주 후 하루 소변 횟수는 extended 그룹은 -1.78±2.39(p<0.0001)이고 changed 그룹도 -1.61±2.32(p<0.0001)로 두 그룹 모두 치료 전에 비해 24주 후 소변 횟수가 유의하게 줄어들었다.
두 그룹 모두 복합제를 복용한 후반 12주간의 변화에 수치상 차이가 나타났다. 후반 12주 동안 하루 소변 횟수 변화는 extended 그룹에서 -0.31±1.53(p<0.05)로 유의하게 감소했지만, 단일제에서 복합제로 투여한 그룹은 그 값이 0.15±1.51로 통계적으로 유의미한 차이가 없었다.
SK케미칼 "24주간 계속 복합제로 복용한 그룹은 하루 소변 횟수에서 12주 이후 추가적으로 증상이 지속적으로 개선됐고, 단일제에서 복합제로 교체 투여한 그룹은 후반 12주간 약효가 유지되는데 그쳤다"라고 설명했다.
그렇다면 24주간 장기 복용시 복합제 개발 목표였던 구갈현상은 얼마나 개선됐을까?
12주간 톨터로딘/필로카르핀 복합제 투여시 구갈 발현정도는 33.06%로 톨터로딘 단일제 투여(45.45%) 대비 유의하게 감소했다(p=0.0427). 12주간 복합제를 연장 투여시에는 12주째에서 24주째 구갈 발현정도가 4.03%[95% CI:1.32, 9.16]였으며, 단일제에서 복합제로 변경한 군에서는 0%[95% CI:0, 2.76]였다. 단일제에서 복합제로 변경한 그룹에서 구갈 이상반응이 한 건도 추가되지 않았다는 점에 놀라운 변화라는 게 SK케미칼 측 설명이다.
구강 건조 증상을 확인하는 지표인 VAS와 구갈 불편함 정도 지표인 XI에서도 12주째보다 24주째 구갈 증상이 완화됐다. 또한 24주째에서도 두 그룹 모두 베이스라인과 비교시 구갈 이상반응 증상이 개선됐다. 특히 단일제에서 복합제로 변경한 군에서 후반 12주 복용시 VAS가 13.12점, XI 총점 2.63점 감소했고, 초록에서는 이를 “드라마틱하게 감소했다”라고 판단했다. 다른 이상반응에 대해서는 두 그룹과 통계학적으로 유의한 차이는 없었다.
최종적으로 연구진은 24주 연구에서 복합제는 안전성과 효능 모두 우수한 상태를 유지했다고 결론내렸다.
SK케미칼 관계자는 “타당성을 인정받지 못한 것은 맞다. 현재 허가를 재추진 할지, 포기할지, 해외 허가절차를 진행할지에 대해서는 결정되지 않았다. 추후 논의해야 하는 상황”이라고 말했다.
▲9월 27일 더케이호텔서울에서 열린 제 69차 대한비뇨기과학회 추계학술대회에서 'THVD-201' 임상3상 결과를 발표하는 고광진 삼성서울병원 교수


















