기업
‘오리지널과 반응률 10.7%差’..삼성 '삼페넷' 허가받은 까닭
바이오스펙테이터 천승현 기자
식약처 중앙약심서 "임상적 동등성 인정" 결론ㆍ일부 불인정 의견도 제시.. 'BPCR 평가변수 설정 타당'
삼성바이오에피스의 ‘허셉틴’ 바이오시밀러 ‘삼페넷’이 오리지널 의약품과 10.7%의 반응률 차이를 나타냈음에도 국내 허가를 받았다. 임상적으로 동등한 수준이라는 다수 전문가들의 의견이 반영됐다. 삼성바이오에피스가 평가변수로 설정한 지표도 문제 없다는 평가가 우세했다.
4일 식품의약품안전처가 공개한 중앙약사심의위원회 회의록에 따르면, ‘삼페넷’의 임상결과에 대해 일부 부정적인 의견이 제시됐지만 다수 의견으로 임상적 동등성이 인정된다는 결론이 도출된 것으로 나타났다. 지난달 9일 허가받은 삼페넷은 로슈의 유방암치료제 ‘허셉틴’의 바이오시밀러다.
식약처의 전문가 자문단체인 중앙약사심의원회는 지난 9월 회의를 열어 삼페넷의 허가 적절성을 여부를 논의했다. 허셉틴과 반응률 격차가 평균 10.7%를 나타낸 것을 두고 동등성을 인정할 수 있는지와 평가변수의 적절성 등이 논의 대상이다.
이와 관련 삼성바이오에피스가 지난 6월 임상종양학회(ASCO)에서 공개한 임상결과를 보면 삼페넷(SB3) 투여군의 ‘유방조직에서의 병리학적 완전관해율’(bpCR)은 51.7%로 허셉틴 군의 42%보다 9.7%포인트 높았다. BPCR은 유방조직에서 종양이 모두 사라진 것을 의미한다. 삼페넷이 오리지널 제품인 허셉틴보다 더 높은 효능을 나타냈다는 해석이 가능하다.
이 통계를 허셉틴 대비 삼페넷의 bpCR 비율로 계산한 값은 1.259[1.112, 1.426]로 미리 설정해둔 범위인 90% 신뢰구간 [0.785, 1.546] 내로 들어왔다. 그러나 bpCR의 차이검증에서 평균값은 10.7%[4.13, 17.26]었지만 상단 값이 17.26%로 사전에 설정한 동등성 범위인 13%을 벗어났다.
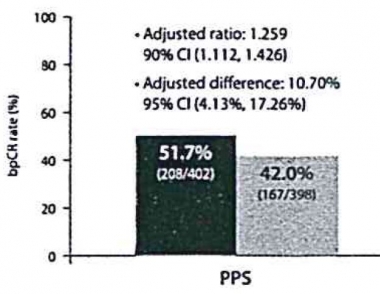
▲삼페넷(왼쪽)과 허셉틴(오른쪽)의 유방조직 병리학적 완전관해율(출처: 2017 ASCO 포스터)
이 임상 결과를 두고 동등성 논란이 제기되기도 했다. 바이오시밀러는 통계적으로 오리지널 의약품과의 동등성을 입증해야 허가받을 수 있다. 효과가 오리지널보다 지나치게 높게 나와도 바이오시밀러로 인정받을 수 없다는 의미다.
삼성바이오에피스 측은 “차이검증에서는 상단이 동등성 범위를 벗어났지만 비율검증에서는 조건을 충족했기 때문에 전체적인 효능 동등성을 입증했다”라고 설명했다.
중앙약사심의원회에서 전문가들은 대체적으로 삼페넷의 임상결과가 동등성을 입증한 수준이라는데 의견을 제시했다.
A 위원은 “통계적인 부분은 충족하지 못했지만 임상적 동등성에 대한 부분은 인정된다”라고 평가했다. B 위원도 “임상적 유효성 면에서의 동등성은 인정된다”라고 판단했다.
C 위원은 “항암제로서 10.7%의 차이는 베이스라인과 관련있는데 베이스라인이 40~50% 범위라면 10.7%는 작은 부분일 것이다”라면서 “기존 화학의약품에서 10.7%의 차이는 크지만 항체의약품으로서 바이오시밀러를 개발할 때 10.7%는 큰 차이가 아닌 것으로 보인다”고 말했다. 해당 약물이 높은 반응률을 보이는 제품이며 화학의약품보다 동등성 입증이 어려운 항체의약품 특성을 고려하면 10.7%의 반응률 차이는 동등성을 확보하는 수준으로 봐도 된다는 설명이다.
반면 D 위원은 “통계적으로 동등성 기준의 상한을 넘으면 바이오시밀러가 아니라고 생각된다”며 동등성이 인정되지 않는다는 시각을 내비쳤다. “동등성 마진 내에 들어와야 한다는 통계적 조건이 있다면 조건에 따라야 한다”라는 동등성 불인정 의견도 개진됐다. 또 다른 위원은 "임상적 해석 등 여러 상황을 고려했을 때 동등성 여부를 판단하기는 어렵다“면서 보류 의견을 냈다.
중앙약사심의위원회는 다수의 의견에 따라 “완전관해율 10.7%는 임상적으로 큰 의미있는 차이는 아닌 것으로 판단된다”라고 결론내렸다.
삼성바이오에피스가 bpCR을 평가 변수로 설정한 것에 대해서도 전문가 회의에서는 문제 없다고 평가됐다.
학계 일각에서는 유방암은 유방 조직 이외에도 액와림프절(겨드랑이림프절)에서도 종양이 발견될 수 있어 ‘유방 및 액와림프절(겨드랑이 림프절)에서의 완전관해율’(tpCR)을 평가하는 것이 바람직하다는 의견을 내기도 했다.
하지만 중앙약사심의원회는 “대리 평가변수로 bpCR의 적용은 인정된다”라고 결론내렸다. 한 위원은 “대리 평가변수와 관련해 과거에는 전통적인 bpCR을 적용했지만 최근에는 tpCR을 많이 적용하는 경향이다”면서도 “이전의 기준을 사용하기는 했지만 현재 시점에서 bpCR을 평가변수로 사용하는 것은 인정 가능하다”라고 판단했다.
회의에서는 바이오시밀러 임상시험 전에 대조약의 변화에 따른 변수를 고려해야 한다는 의견도 제시됐다. 삼성바이오에피스 측은 반응률 차이가 발생한 이유에 대해 “대조약을 모니터링한 결과 역가에 영향을 미치는 ADCC(항체의존 세포매개 세포독성)에 변화가 있는 것을 확인, 임상시험에서 동등성 마진을 벗어나는 결과가 발생했다”고 주장했다.
E 위원은 “품질과 관련한 대조약의 역가 변동은 대조약 제조사의 원인이므로 이를 가지고 옳고 그름을 얘기할 수 없다”라고 지적했다. F 위원은 “대조약의 변동에 따라 동등성 기준을 벗어났는데 변동이 없는 대조약으로 추가 평가를 했으면 좋겠다”면서 추가 임상시험 필요성을 주문했다. 이에 대해 중앙약심위원회는 “대조약의 변동이 있다면 미리 대조약의 역가를확인하고 동등성 평가를 위한 임상시험을 실시하면 좋겠다”라고 지적했다.
식약처의 구체적인 바이오시밀러 동등성 평가 가이드라인 요구하는 목소리도 있었다. 한 위원은 “앞으로 바이오시밀러 동등성 판단에 대한 식약처의 기준을 명문화해 판단 근거로 마련하면 좋을 것”이라고 권고했다.



















