기업
유전자치료 연구 감염병·만성질환 허용..한국형 클리아랩 도입
바이오스펙테이터 장종원 기자
복지부·식약처, 규제개선안 발표..개인의료 유전자 검사 항목 확대 추진
앞으로 암과 에이즈 등 일부 질환에만 허용됐던 유전자 치료 연구의 제한이 사라진다. 차세대염기서열분석(NGS) 유전자 패널검사를 유전체 분석회사에서도 가능하도록 하는 한국형 클리아랩(CLIA LAB)도 도입된다.
보건복지부와 식품의약품안전처는 22일 청와대에서 대통령 주재로 열린 ‘규제혁신 토론회’에서 이 같은 내용을 담은 규제개혁안을 발표했다.
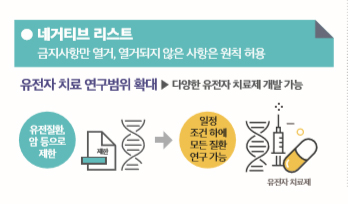
정부의 이번 규제개혁안의 핵심은 '포괄적 네거티브' 방식의 도입이다. 포괄적 네거티브 규제는 신산업을 우선 허용하고 사후에 규제하는 방식이다. 구체적인 안으로 원칙적으로 허용하고 예외적으로 금지하는 네거티브 리스트, 포괄적 개념 정의, 유연한 분류체계, 사후 평가관리 등이 포함된다.
먼저 유전자 치료 연구의 범위에 '포괄적 네거티브' 방식을 도입한다. 암과 에이즈, 유전질환 등에만 허용됐던 연구를 제한 없이 풀기로 했다. 일정 조건만 준수하면 감염병 질환과 만성 질환 등 모든 질환에 대해서도 유전자 치료 연구가 가능하도록 하겠다는 방침이다. 현행 생명윤리법은 유전자 치료 연구범위는 각종 질환으로 확산되는 전세계 유전자 치료 연구의 흐름에 뒤쳐진다는 비판을 받아왔다. 정부는 "그간 유전자 치료 연구가 금지된 질환에 대한 새로운 유전자 치료제 개발을 촉진할 수 있을 것으로 기대된다"고 밝혔다.

▲'생명윤리 및 안전에 관한 법률' 47조에 담긴 유전자 치료 허용 범위. 정부는 암과 에이즈, 유전질환 등에만 허용됐던 연구를 제한 없이 풀기로 했다.
차세대염기서열분석(NGS) 유전자 패널검사의 비의료기관 위탁도 허용한다. 현재는 비의료기관인 유전체분석기업은 의료기관으로부터 NGS 기반 유전자패널검사 수탁이 불가능했다. 정부는 이를 위해 미국의 실험실 표준인증(CLIA) lab에 착안했다. 미국은 CLIA를 받은 연구소 등에서 개별적으로 암 패널 진행하고 있다. 국내도 인증을 받은 검사실에서는 검사 시행은 물론 수가 청구가 가능토록 하는 한국형 CLIA법을 제정키로 했다.
이와 함께 개인 의뢰 유전자 검사(DTC)도 개선된다. 먼저 DTC의 소비자 광고를 허용한다. 질병의 예방 및 건강관리 목적의 DTC는 의료로 보기 어려우나 의료광고로 규제해왔다. 복지부는 "DTC는 의료행위가 아니므로 의료법의 적용을 받지 아니하고, 해당 광고도 의료광고가 아니므로 의료법 규율사항이 아닌 것"으로 유권해석했다.
DTC 검사 항목도 확대한다. DTC가 12개 항목으로 제한돼 질병의 예방 목적 달성과 DTC 시장의 활성화 모두 미미했다는게 정부의 평가다. 정부는 DTC 제도 개선을 위해 제도의 효과성, 문제점 등을 분석 하고, 관련 전문가협의체를 구성해 논의를 추진한다.
이밖에도 체외진단의료기기의 신의료기술 평가도 개선한다. 기존의 임상 문헌 중심의 평가를 대체하는 대안을 마련해 체외진단기기의 신의료기술 진입을 촉진할 계획이다. OECD 비회원국의 비임상시험 기준(GLP) 자료 상호인정을 확대해 중국 비임상 실시기관의 GLP 자료의 인정 여부에 대한 대안을 마련키로 했다. 현행 신장, 간장, 췌장, 골수 등 13종으로 제한한 장기이식도 대상을 장기 종류의 상고나 없이 의학적으로 필요하다고 판단되면 이식을 허용하는 안도 이번 규제 혁신안에 담겼다. 이에 따라 살아 있는 사람의 폐나 얼굴, 발 등도 장기이식이 가능해진다.



















