기업
브릿지바이오 "IPO 기평 신청..올해 3번째 물질도입"
바이오스펙테이터 김성민 기자
올해 마일스톤으로 BBT-401 임상1상 종료 및 BBT-877 미국 IND filing 목표

"올해 마일스톤으로 BBT-401의 임상1상을 마칠 예정이며, 3번째 파이프라인으로 신규물질을 도입할 예정이다. 지난해 레고켐바이오사이언스에서 도입한 BBT-877은 현재 GLP독성시험에 돌입했으며 올해 미국 IND filing을 목표로 한다."
이정규 브릿지바이오 대표는 지난 19일 오후 개최한 Webinar IR(2018 Q1)에서 이같은 내용을 발표했다. 브릿지바이오는 미국 임상1상 단계의 궤양성대장염 치료제 후보물질인 'BBT401'과 전임상 단계의 특발성 폐섬유증 치료제 후보물질인 'BBT-877'을 파이프라인으로 보유하고 있다.
브릿지바이오는 올해 IPO(기업공개)를 진행하기 위해 주관사로 KB증권을 선정했으며, 지난주 기술성평가 평가기관 지정 신청을 거래소에 제출한 상태다.
이 대표는 "브릿지바이오는 혁신신약 중심의 신약발굴 기업으로 외부에서 우수한 물질을 도입해 개발에 중점두는 NRDO(개발중심 바이오벤처) 모델"이라고 설명했다. 회사는 이를 위해 전문가로 구성된 내부개발역량을 갖추고 있으며, 외주를 통해 개발하는 모델이라는 설명이다.
이 대표는 3가지 비전으로 "이제까지 국내에서 20년간 꾸준히 연구개발한 기관이 보유한 혁신신약 씨앗을 찾고 있다"며 "특히 개발후보단계 과제에 포커스하고 있다"고 설명했다. 두번째로는 국내, 나아가 아시아에서 자금을 유치한다. 그러나 개발은 철저하게 "day1부터 글로벌 개발을 지향한다"고 강조했다. 세번째로는 미충족수요가 높은 후보물질 중 중개가능성이 높은 약물을 집중한다는 설명이다. 그는 덧붙여 글로벌 경쟁에서 '속도'가 중요하다고 강조했다. 정부과제를 통한 연구비 조달에는 속도가 제한적이기 때문에 연구개발 비용의 전액은 벤처케피탈에서 조달한다는 전략이다.
이 대표는 "IPO 전까지는 비항암제 저분자화합물 개발에 나서지만, IPO를 통해 충분한 자금조달을 한 다음부터는 바이오의약품과 면역항암제 분야까지 진출할 계획도 갖고있다"고 말했다.
현재 미국 임상1상을 진행하는 BBT-401은 펠리노-1 저해제로 궤양섬대장염 치료제다. 'first-in-class' 가능성을 지닌 약물이다. 궤양성대장염은 대표적인 염증질환으로 대장의 끝부분에서 만성염증으로 인한 궤양이 발생해 혈변, 잦은 설사, 복부통증 등으로 일상적인 생활에 지장을 초래하는 질환이다. 2015년 기준으로 국내에 3만5623명의 환자가 있으며 청년층에서 높게 발병한다. 전신성질환인 크론병에 비해 발병범위나 염증의 심각도는 작으나, 현재 1차약제가 효력이 제한적인 실정으로 약물효능이 우수한 1차약제의 미충족수요(medical unmet needs)가 높은 질환이다.
현재 1차약제로 70% 환자에 5-ASA(펜티사, 아시콜)가 투약되며 완전관해율은 20%, 반응률은 50%로 나타난다. 5-ASA가 듣지않는 환자에 2, 3차 약제로 단기적으로 스테로이드가 처방되며 오자니모드(ozanimod), 젤젠즈(xeljanz)가 처방된다. 최종약제로는 고가의 항 TNF 항체(엔브렐, 휴미라)가 쓰인다. 항체약물은 반응률이 80%로 높은 수치를 보인다.
BBT-401은 항염증 작용을 하며 동시에 장점막치료 효과를 구현할 가능성이 있다는 게 회사측의 설명이다. 이 대표는 타깃 시장으로 "5-ASA 대체하거나, 혹은 병용투여하겠다는 목표다"며 "1차 약제로서 장점막 개선효과를 고려했을 때 항 TNF 약물처방 지연하거나 혹은 줄일 것으로 예상한다"고 말했다.
전임상에서 브릿지바이오는 BBT-041의 궤양성대장염 치료제로서의 가능성을 확인하기 위해 DDS(Dextran sulfate sodium)-유발 생쥐 대장염 모델을 이용했다. 독성 화학물질인 DDS를 물에 섞어서 5일 동안 먹이게 되면 DDS가 장내 표피세포에 들어가 세포층을 파괴하는 역할을 한다. 이로써 소장에서 대장까지 전반적인 내장기관에 지속적인 염증반응이 유도되며 혈변증상이 나타나는 모델로 가장 널리 이용된다. 대장염 질환정도지수에서 0은 아무 증상이 없으며 11은 사망에 이르는 심각도를 갖는다는 설명이다. DDS는 x축 기준 day 0~4일의 5일동안 투약했다. 전임상 실험에서는 DDS 먹인후 15일째 되는날 쥐의 대장조직의 증상을 확인했다.
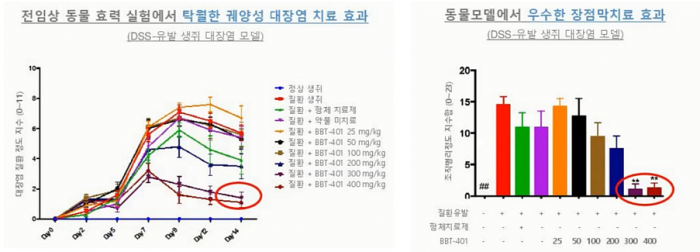
▲ DDS-유발 생쥐 대장염 모델에서 BBT-401의 효능평가
그결과 조직병리학적으로 고용량투여군(300, 400mg)에서 대조군 대비 유의미한 장점막치료 효능을 관찰했다. 또한 GLP독성시험에서 우수한 약물내약성 및 안전성을 확인했다고 밝혔다. NOAEL(최대 무독성용량)은 랫(rat)에 1000mg/kg/day, 비글에 250mg/kg/day의 약물이 28일동안 투약됐으며, 사람기준 10g에 해당하는 수치다.
이 대표는 "이번주에 피험자에 첫 투약을 시작하며 3분기 안에 단회투여가 마무리될 것으로 내다본다"며 "4분기에는 약물 반복투여(MAD)를 종료할 계획이다"고 말했다. 약물테스트 및 시료생산은 우시앱택에 위탁했으며, 임상1상은 미국 Celerion에서 진행한다.
지난해 레고켐바이오로부터 도입한 오토택신 저해제인 BBT-877는 현재 GLP독성시험을 시작했으며, 특발성 폐섬유증을 타깃해 올해내에 미국 IND filing을 할 계획으로 내년 임상1상 돌입을 계획하고 있다.
이 대표는 "브릿지바이오는 초기부터 미국, 중국에 함께 임상돌입할 수 있도록 IND를 준비할 계획"이라며 "12개월 내에 변곡점 이벤트를 제공할 수 있을 것이다. 한국기반의 글로벌 혁신 바이오텍이 되도록 노력하겠다"고 강조했다.
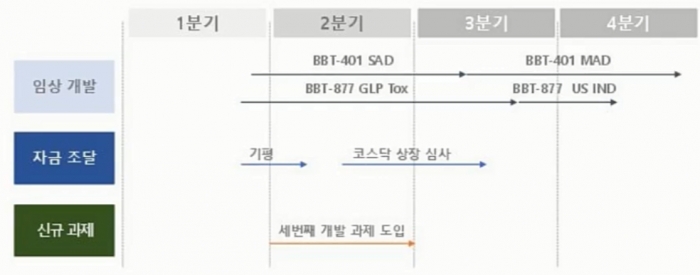
▲올해 주요 마일스톤



















