기업
셀트리온 "램시마SC, 임상3상서 안전성·효능 입증"
바이오스펙테이터 장종원 기자
유럽 류마티스 학회서 램시마SC 3상 결과 첫 공개.."램시마SC 30주까지 램시마IV와 유사한 효능, 안전성 확인"
셀트리온이 인플릭시맙 피하주사 제형인 램시마SC의 임상 3상 결과를 유럽에서 최초로 공개했다. 셀트리온은 작년 12월 유럽의약품청(EMA)에 램시마SC 허가를 신청했으며 올해 하반기 허가를 기대하고 있다.
셀트리온은 스페인 마드리드에서 12일부터 15일까지 개최되는 2019 유럽 류마티스 학회(EULAR, The European League Against Rheumatism)에서 램시마SC의 유효성과 안전성을 확인한 임상 1∙3상 파트 2결과를 최초 공개했다.
이번 임상은 벨기에의 루벤 가톨릭의대 Rene Westhovens 교수팀이 류마티스관절염 환자 362명을 대상으로 램시마(IV)와 램시마SC의 유효성의 비열등성을 확인하고 안전성을 비교하기 위해 진행됐다.
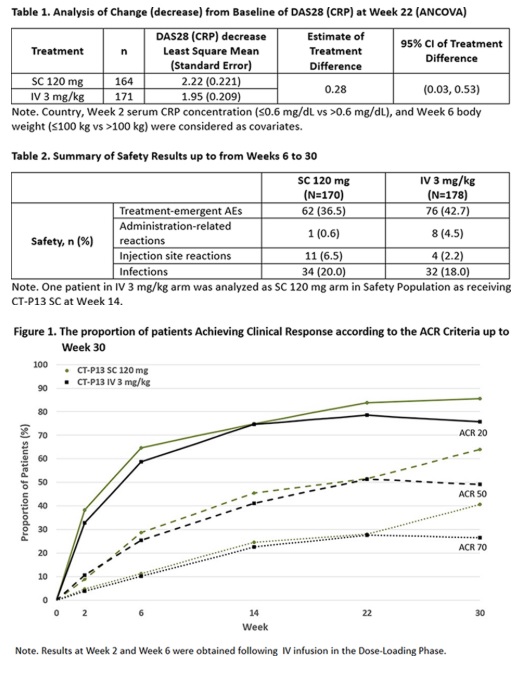
연구진은 피험자를 0주와 2주째 램시마 IV 3mg/kg을 투여하고 6주째 1대 1 비율로 램시마SC 120mg 또는 램시마 IV 3mg/kg군에 배정했다. 그리고 30주째 부터는 모든 환자에게 2주마다 램시마 SC 120mg을 투여했다.
그 결과 치료 22주째 기저 대비 유효성 평가변수인 DAS28(disease activity score with 28-joint assessment)은 두 그룹간 유사했다. ACR(American college of rheumatology) 반응을 포함한 효능은 22주째까지 두 그룹이 유사했으나 30주째에는 SC군에서 반응률이 약간 더 높은 경향이 관찰됐다. 약물의 안전성 프로파일은 두 그룹 간 유사했다.
연구진은 "램시마SC가 류마티스관절염 환자에게 편의성이 높은 또 다른 부가적 처방 수단이 될 수 있다는 결론을 얻었다"며 "특히 효과면에서도 램시마에 대한 램시마SC의 비열등성이 입증됐다"고 밝혔다.
셀트리온 임상개발본부 이상준 수석 부사장은 "셀트리온은 이번 임상 결과 발표를 통해 램시마의 듀얼 포뮬레이션 치료 전략의 성공 가능성을 증명했다"며 "셀트리온은 효과와 안전성을 증명한 임상 데이터를 바탕으로 활발한 학술 마케팅에 돌입했다. 램시마SC를 세계 매출 1위 블록버스터 의약품인 휴미라를 넘어설 수 있는 글로벌 블록버스터 제품으로 육성해 나갈 계획"이라고 밝혔다.
한편 셀트리온은 전세계 램시마 처방 환자 총 4400여 명의 Real World Data 중 류마티스 관절염, 강직성척추염, 건선성 관절염, 건선 환자 약 1500여명의 자료를 추려 램시마의 장기 안전성을 분석한 시판후연구 결과 등도 함께 발표했다.
셀트리온은 이번 연구 결과를 통해 램시마의 주요 안전성 프로파일인 심각한 감염과 결핵 발생에 대한 분석 결과가 기존 오리지널 의약품의 여러 연구 결과와 비교해 그 발생률이 동등한 수준임을 확인했다.


















