국제
노븐, 패치형 조현병 치료제 '세쿠아도' "美FDA 승인"
바이오스펙테이터 이승환 기자
패치 형태로 24시간 부착해 아세나핀(asenapine) 투여하는 ‘세쿠아도(Secuado)’..美FDA가 승인한 첫 패치형 조현병 치료제

팔, 등, 배, 엉덩이에 부착해 아세나핀(asenapine)을 투여하는 패치형 조현병 치료제 ‘세쿠아도(Secuado)’가 미국 식품의약국(FDA)의 승인을 받았다. FDA의 승인을 받은 패치 형태의 조현병 치료제는 세쿠아도가 처음이다.
노븐 파마슈티컬스(Noven Pharmaceuticals)는 세쿠아도가 FDA의 승인을 받았다고 15일(현지시간) 발표했다. 세쿠아도는 18세 이상 성인 조현병 환자를 대상으로 사용하며, 1일 1회 부착 후 24시간 동안 아세나핀을 피부로 투여한다.
FDA로부터 2009년 8월 승인받은 비정형 항정신병제 아세나핀은 비정형 사환계 항우울제 미안세린(mianserin)의 구조를 변형해 만들어졌다. 아세나핀은 조현병과 양극성 장애의 급성 조증 치료를 목적으로 사용한다. 두 질환의 증상을 완화하는 아세나핀의 기전은 정확히 밝혀지지 않았다. 아세나핀이 결합하는 대상은 세로토닌, 아드레날린, 도파민, 히스타민 수용체다. 이 수용체들에 결합한 아세나핀은 주로 길항제(antagonist)로 작용한다. 세로토닌 수용체의 하위유형인 5-HT1A 수용체에는 부분적인 작용제(partial agonist)로 기능하는 것이 알려졌다.
노븐은 세쿠아도 패치에 있는 아세나핀 가운데 60% 정도가 24시간 안에 체내로 흡수된다고 밝혔다. 세쿠아도를 부착하고 12~24시간 안에 체내 아세나핀 농도가 최대치에 이르며, 패치를 제거하고 난 후의 아세나핀의 반감기는 대략 30시간이라고 설명했다. 흡수된 아세나핀의 약 50%는 소변, 약 40%는 분변에서 검출됐다.
세쿠아도 승인의 근거가 된 임상3상(HP-3070, NCT02876900)은 607명의 조현병 환자를 대상으로 진행했다. 6주간 세쿠아도 3.8mg 저용량 투여그룹, 세쿠아도 7.6mg 고용량 투여그룹 그리고 위약그룹으로 나누어 증상변화를 관찰했다. 증상변화를 관찰하는 기준으로 조현병 환자의 양성증상, 음성증상을 판단하는 척도인 PANSS(Positive and Negative Syndrome Scale)를 사용했다. HP-3070 연구에서 6주간 임상시험을 진행한 결과, 위약군 대비 PANSS 척도가 감소한 정도는 세쿠아도 저용량 투여그룹 –6.6점, 세쿠아도 고용량 투여그룹 –4.8점였다.
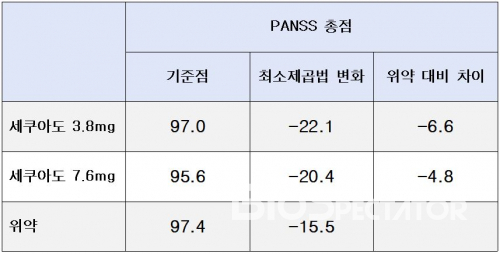
▲HP-3070 연구 결과(세쿠아도 처방 정보, FDA)
조현병은 망상, 환청, 언어장애, 사고장애 등 다양한 증상이 나타난다. 이 증상들을 크게 나누어 양성증상, 음성증상으로 구분한다. 정상인에겐 나타나지 않는 불안, 망상, 환각 등은 양성증상으로 구분한다. 음성증상은 정상인에게 있어야 하지만 조현병 환자에겐 사라진 증상으로, 무관심, 정서둔마(affective flattening), 의욕결여(avolition), 무감동증(anhedonia), 무언어증(alogia), 사회적 고립(asocialia) 등이 있다. 총 30가지 항목으로 구성된 PANSS 척도는 7가지 양성증상, 7가지 음성증상, 16가지 일반정신병리를 판단한다. 각 항목을 증상이 없는 것으로 판단하는 1점부터, 심한 수준의 증상을 보이는 7점까지 평가한다.
세쿠아도 부착으로 발견한 주요 부작용은 근육 긴장 이상을 유발하는 추체외로 증상, 부착 부위 반응, 체중 증가였다. 임상시험과정에서 세쿠아도 사용으로 생긴 오남용 사례는 없었다고 밝혔다.

















