기업
압타머사이언스 "폐암진단키트 조만간 허가신청, 올해 상용화"
바이오스펙테이터 조정민 기자
확증임상 마무리 단계..이르면 이달 중 식약처 품목허가 신청

새로운 폐암진단키트가 국내 임상을 마무리하고 품목허가 신청을 앞두고 있다. 암으로 추정되는 신체의 조직 일부를 떼어내 검사하는 생검(biopsy) 대신 혈액으로 암을 간단히 진단하는 액체생검 시대를 앞당기기 위한 경쟁이 불붙고 있다.
한동일 압타머사이언스 대표는 최근 바이오스펙테이터와 만난 자리에서 "압타머(Aptamer)를 활용한 폐암진단키트의 확증 임상이 마무리 단계"라면서 "조만간 식품의약품안전처 품목허가 신청을 할 계획으로 올해 내 상용화를 기대하고 있다"고 말했다 .
폐암의 경우 2015년 통계 기준으로 국내에서 연간 2만5000여 명의 환자가 발생했으며 1만7000여 명 이상의 환자가 사망했다. 초기의 폐암은 증상이 나타나지 않기 때문에 60% 이상의 환자가 질병이 진행된 이후 발견하게 된다. 폐암 1기에 발견한 환자의 5년 생존율이 70% 가량인데 비해, 2기 이상으로 진행된 후 진단이 이뤄진 환자의 5년 생존율은 10%에도 이르지 못한다. 따라서 폐암의 조기발견은 사망률을 낮추는 데 아주 중요한 과제로 많은 연구자들이 정확하고 빠른 폐암 진단을 위해 노력해왔다.
최근 조기폐암검진에서 낮은 방사선양으로 CT를 촬영해 폐암의 증상 중 하나인 결절(nodule)의 존재 유무를 관찰하는 LDCT(low-dose chest computed tomography)가 사용됨으로써 폐암 조기 발견율이 높아졌으나 이 역시도 암과 무관한 양성 결절로 인해 높은 위양성(False-positive)의 문제점이 지적되고 있다.
압타머사이언스는 다양한 표적 리간드에 특이적으로 결합을 이루는 안정적 삼차구조의 분자물인 압타머를 이용한 멀티-바이오마커 진단키트를 개발하고 있으며 폐암을 일차 적응증으로 100명의 폐암진단 환자를 포함한 총 200여명의 한국인을 대상으로 탐색 임상을 진행했다. 임상 결과는 작년 9월 해외학술지 'Clinical lung cancer' 게재 승인받았고 지난 주 출판됐다.
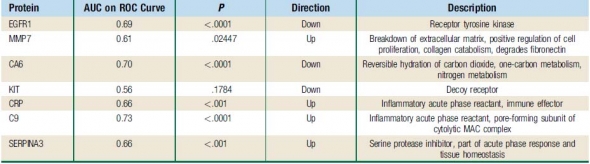
▲압타머사이언스의 폐암진단에 사용된 7개의 바이오마커.
논문에서 압타머사이언스는 한국인에게 적합한 바이오마커를 발굴해, 비소세포폐암(NSCLC)의 조기 발견과 진단이 가능한 키트를 개발하고 그 정확도와 민감성을 확인하기 위한 실험을 진행했다. 서울아산병원을 통해 대상자를 모집했으며 CT 촬영을 받은 건강한 사람 100명과 LDCT에서 결절이 발견된 이후 폐 생검을 통해 폐암을 확진 받은 환자 100명, 총 200명의 혈액 샘플을 이용했다.
압타머사이언스는 미국 등에서 진행된 임상을 참고해 후보 타깃 단백질들을 선별해 14개의 단백질 패널 분석을 마련했다. 각 마커들의 정확도(AUC)를 비교한 끝에 EGFR, MMP7,CA6 등의 7개의 잠재적 바이오마커를 선정했다.
7개의 마커를 이용해 샘플들을 분석하고 진단 결과를 비교한 결과 대조군 전체와 환자군 전체 샘플의 경우, 환자 선별 정확도가 82% 이상이었으며 양성 결절이 발견된 대조군 대상자와 폐암 환자군을 선별하는데 있어서 90%의 정확도를 보이는 것을 확인했다.
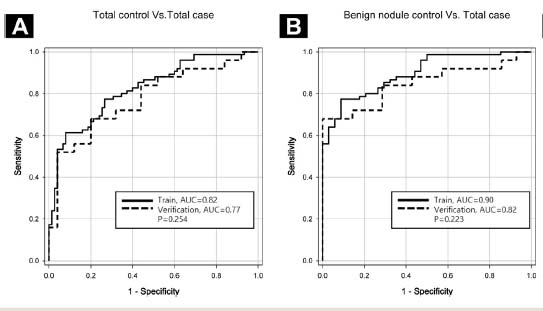
▲압타머사이언스의 진단키트 정확도(AUC)비교.
또한 Cyfra-21을 이용한 선별과의 정확도 차이를 비교했다. Cyfra-21은 폐의 편평상피암 및 선암의 진단, 경과 관찰에 이용되는 종양 표지자로 널리 사용되고 있지만 1기와 같은 초기 폐암을 진단하는데 있어서 민감도가 낮은 단점이 있다.
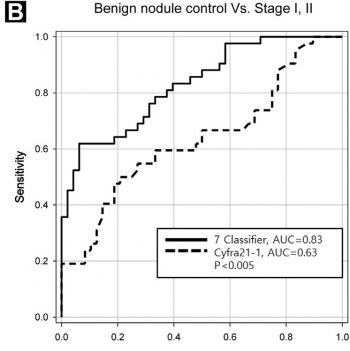
▲Cyfra-21과 압타머사이언스 진단키트의 선별 정확도 비교. 압타머사이언스 제공.
실험 결과, 1/2기의 초기 단계의 환자 샘플에서 Cyfra-21를 이용한 진단의 경우 63%의 선별 정확도를 보인 반면 압타머사이언스의 진단키트는 83%의 정확도를 나타냈다. 회사 측은 이러한 결과를 토대로 자사의 폐암진단키트가 초기 폐암의 발견과 진단에 유용한 도구로 사용될 가능성이 있다고 판단했다.
압타머사이언스는 이런 탐색 임상 결과를 바탕으로 식약처 허가를 위한 확증임상에 돌입했으며 현재 마무리단계다. 압타머사이언스 관계자는 "아직 임상 결과가 블라인드(비공개) 상태이지만 탐색 임상과 같은 우수한 진단결과를 기대하고 있다"면서 "이르면 이달 말 식약처 품목허가 신청이 가능할 것"이라고 말했다.
한편 혈액으로 폐암을 진단하는 검사는 지난해 로슈분자시스템(Roche Molecular Systems)이 미국 FDA로부터 최초 승인받았다. 국내에서는 파나진이 지난달 PNA를 활용한 폐암진단키트 '파나뮤타이퍼 EGFR'를 허가받았다.


















