국제
써모피셔, NGS 비소세포폐암 동반진단 3종 FDA 허가
바이오스펙테이터 조정민 기자
타핀라-맥키니스트 병용투여, 잴코리, 이레사 대상자 선별
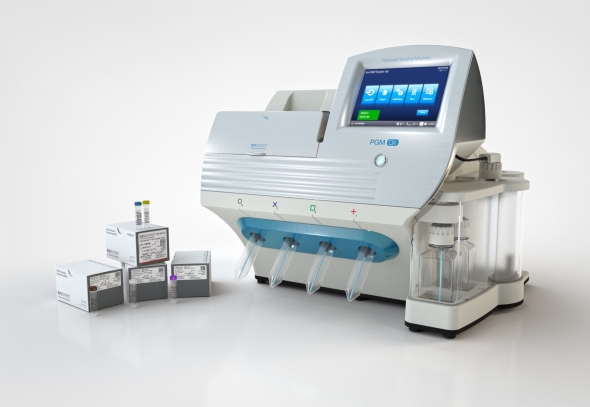
써모 피셔(Thermo fisher)의 NGS 기반 동반진단 ‘온코민DX(Oncomine Dx)’가 지난 23일(현지시각) 3가지 비소세포폐암 치료에 적합한 환자를 선별하는 동반진단으로 FDA의 허가를 받았다.
Oncomine Dx는 종양샘플을 이용한 대량 신속처리, 병행 시퀀싱 기술로 비소세포폐암 유전자에 대한 스크리닝을 진행한다. FDA는 이를 통해, BRAF V600E 변이를 가진 노바티스의 타핀라와 맥키니스트 병용 투여 대상 환자와 ROS1 병합을 나타내는 화이자의 잴코리 투여 대상자, EGFR L585R 변이와 Exon 19 삭제를 보이는 아스트라제네카의 이레사 대상자를 선별하는 것을 허가했다.
써모 피셔의 NGS-종양 연구소장인 조이딥 고스와미(Joydeep Goswami)는 “비소세포폐암과 싸우는 환자들은 시간이 가장 중요하다. Oncomine Dx는 종양학자들이 비용-효율적이며 효과적인 정밀-타깃 치료법을 빠르게 선택할 수 있도록 도와줄 것”이라고 말했다.
써모 피셔는 10ng의 핵산을 이용해서 수백 개의 유전적 마커를 분석할 수 있는 ‘Ion AmpliSeq’ 패널을 이용한 Oncomine Dx를 개발했다. Ion AmpliSeq 패널은 특정 유전자 부분을 증폭하도록 디자인한 올리고뉴클레오타이드 프라이머로 구성돼 있다. 각 패널은 유전자의 모든 염기를 검토하거나 특정 유전적 변이가 많이 일어나는 부분에 집중해 정보를 얻을 수 있다.
패널에 샘플을 적용한 이후에는 자사의 'Ion PGM Dx system'을 이용해 분석한다. FDA로부터 510K 승인을 받은 Ion PGM Dx system은 차세대 염기서열 분석 기기로 전용 칩과 키트를 사용해 대량의 샘플을 동시에 처리하는 것이 가능하다. 또한 실행 시간이 5시간 이내로 짧아 전체적인 분석과 진단까지 걸리는 시간을 단축했다.
NGS를 기반으로 하는 동반진단으로써 FDA의 허가를 받았지만 아쉬운 점도 남았다. Oncomine Dx는 비소세포폐암에 대한 23개의 유전자를 분석할 수 있지만, FDA는 BRAF V600E, ROS1, EGFR 3개의 유전자에 대한 진단만을 허가했다. 나머지 20개의 유전자에 대한 충분한 임상적 근거가 부족한 것을 원인으로 유추할 수 있다.
회사 측은 테스트의 적용을 확대하기 위해, 20가지의 비소세포폐암 관련 유전자에 대한 임상시험을 진행, 평가할 계획이다. 고스와미는 “이번 허가는 첫 시작일 뿐이다. 현재 폐암에 대한 FDA의 허가를 받은 타깃 치료에 패널을 사용하기 위해 다양한 제약회사들과 논의를 하고 있다”고 밝혔다.


















