국제
Solid Biosciences, 'DMD 유전자치료제' 임상1/2상 재개
바이오스펙테이터 이은아 기자
임상프로토콜 변경, 3개월만에 임상보류 해제..'SGT-001' AAV9로 마이크로디스트로핀 유전자 채내 전달

솔리드 바이오사이언스(Solid Biosciences)는 FDA가 임상보류 됐던 듀센형 근이영양증(Duchenne muscular dystrophy, DMD) 대상 SGT-001 임상시험이 지난주 FDA로부터 해제되면서 임상을 재개한다고 밝혔다. 임상보류 조치된 지 3개월만이다.
지난 3월, 솔리드는 DMD 소아 및 청소년 대상 ‘SGT-001’의 임상1/2상 시험(IGNITE DMD)에서 첫번째 약물 투여를 받은 청소년 환자에서 중대한 이상반응이 관찰돼 FDA로부터 임상보류 통보를 받았다. 당시 환자는 투여 후 며칠동안 보체의 활성화 및 적혈구 수 저하로 인해 혈소판 수가 감소하고 일시적으로 신장이 손상되는 증상이 관찰됐다. 출혈이나 혈액응고의 징후나 간 기능 장애에 대한 증상은 나타나지 않았다.
솔리드는 예기치 않은 이상반응 증상이었기 때문에 FDA에 바로 보고했으며 FDA는 이를SUSAR(Suspected Unexpected Serious Adverse Reaction)로 분류해 임상보류 결정을 내렸다. 임상보류 통보 후 솔리드는 임상시험 환자등록 및 투약을 중단했고, 해당 환자는 보체 활성화에 대한 표준 치료법인 변형 스테로이드와 에쿨리주맙(Eculizumab) 투약 후 안정을 되찾았다.
임상보류 해제된 암싱시험에서 솔리드는 프로토콜을 변경했다. SGT-001 투여 후 첫 주에 글루코코르티코이드(glucocorticoids)를 정맥주사하고 보체 활성화를 위한 패널을 포함하는 모니터링을 강화했다. 보체 활성화가 관찰되는 경우에는 에쿨리주맙을 치료 옵션으로 사용할 수 있다고 명시했다. 솔리드는 몇몇 어린이 환자 등록 및 투약 후에 추가로 청소년 환자를 등록할 계획이다. 또한 마이크로디스트로핀(microdystrophin) 발현 시간에 대한 추가 정보를 수집하기 위해 SGT-001 투여 후 45일째 중간근(intermediate muscle) 생검을 선택하도록 했다. 임상시험의 중간분석 초기 결과는 2019년 하반기에 도출될 전망이다.
Ilan Ganot 솔리드 바이오사이언스 설립자이자 대표는 “SGT-001은 연령과 질환 단계에 관계없이 DMD환자에게 상당한 이점을 제공할 잠재력이 있다”면서 “FDA로부터 임상보류 결과가 해제되면서 유전자 치료법을 계속 개발할 수 있게 돼 기쁘다”고 밝혔다.
Barry Byrne 플로리다 대학 Powell Gene Therapy Center 소장은 “유전자 치료는 DMD의 과정을 변화시킬 잠재력이 있으며 치명적인 질병으로 고통받는 사람들에게 장기적인 혜택을 줄 수 있다”며 "환자의 임상 및 실험실 데이터를 철저히 분석해 쉽게 모니터링하고 의학적으로 관리될 수 있을 것”이라고 말했다.
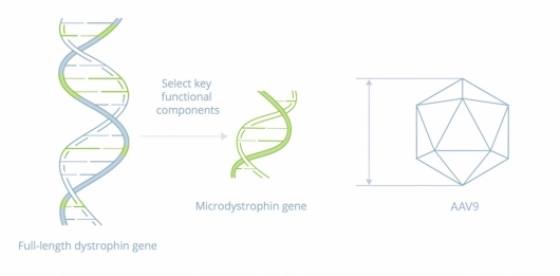
▲Solid Biosciences의 'SGT-001' 모식도 (회사 홈페이지 참조)
한편, 듀센형 근이영양증(DMD)은 X염색체 상에 있는 디스트로핀(Dystrophin) 유전자 변이로 디스트로핀 단백질 생성에 문제가 생겨 심각한 근육위축이 나타나는 유전성 희귀질환이다. 주로 남성에서 발병하며 3~5세부터 증상이 발현돼 30세 이전에 사망에 이르게 된다.
솔리드의 DMD 신약 후보물질 SGT-001은 합성 디스트로핀 전이유전자(synthetic dystrophin transgene)인 마이크로디스트로핀(microdystrophin)를 체내에 전달함으로써 치료하는 기전이다. 마이크로디스트로핀은 근육에서 발현되는 기능성 단백질로 발현되며 신경성 산화질소 합성효소(neuronal nitric oxide synthase, nNOS)를 포함하는 필수 단백질을 안정화시키는 역할을 한다. 이때 SGT-001은 아데노연관바이러스9(Adeno-Associated Virus9, AAV9)를 이용한다.
이미 비임상 결과에서 SGT-001은 유전적 돌연변이나 질환 단계에 상관없이 DMD의 진행을 늦추거나 중단시킬 가능성을 관찰했다고 보고한 바 있다.


















