국제
美 FDA, 2018년 신약 59종 허가..20년만에 '최대'
바이오스펙테이터 장종원 기자
2018년 신약 허가 현황 분석..스콧 고틀립 체제 이후 신약 허가 급증..56%가 희귀의약품
미국 식품의약국(FDA)의 신약 허가 건수가 20여년만에 최대치를 기록했다. 적극적인 희귀질환 치료제(Ophan Drug Designation), 혁신치료제(Breakthrough Therapy Designation) 지정과 신속심사(Fast track) 등 지원제도 활용으로 인한 결과다.
2일 FDA에 따르면 2018년 새롭게 허가된 신약은 59건으로 집계됐다. 2016년 22건에 불과했던 신약허가는 2017년 스콧 고틀립 체제에 들어서면서 46건으로 두배 이상 증가했는데 작년에는 이전 최대치였던 1996년(53건) 기록을 넘어섰다.
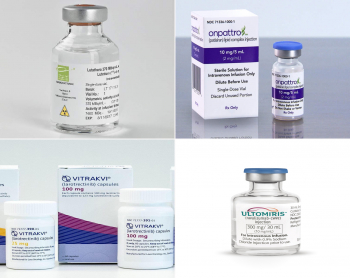
2018년 첫 승인 약물은 치료용 방사성 의약품 ‘루타테라(Lutathera)’다. 루타테라는 노바티스가 2017년 39억달러에 인수한 프랑스 AAA(Advanced Accelerator Applications)가 개발한 제품이다.
위장관췌장 신경내분비종양 치료제로 승인받은 루타테라는 연간 20억달러의 매출이 기대되는 약물로 주목받고 있다. 출시된 작년 3분기에만 총 5600만달러의 매출을 올렸다.
최초의 RNAi(RNA interference) 기반 치료제도 2018년 탄생했다. 앨라일람이 개발한 ‘온파트로(Onpattro; Patisiran)’는 다발성신경병증을 동반한 hATTR 아밀로이드증 치료제로 승인받았다. 생물학의 중요 돌파구로 주목받았지만 체내 불안정성 등의 문제로 신약 탄생이 요원하던 RNAi 기반 치료제가 탄생한 것에 대해 “질병의 근본적인 원일을 타깃하는 치료에 있어서 진보를 이룩했다”는 평가를 얻었다.
항암 치료의 대세로 자리매김한 면역관문억제제도 추가됐다. FDA는 작년 10월 국소진행성 피부 편평세포암(Cutaneous squamous cell carcinoma, CSCC)의 치료제로 리제네론의 리브타요(Libtayo, cemiplimab-rwcl)를 허가했다. 옵디보와 키트루다의 뒤를 이은 3번째 PD-1 타깃 치료제다.
2017년 키트루다가 종양의 특정 위치에 따른 적응증이 아니라 바이오마커에 따라 투여가 결정되는 최초의 항암제로 승인된 이후 2018년 후반기에도 또 다른 바이오마커 항암제가 탄생했다. 지난 11월 FDA가 록소 온콜로지와 바이엘의 경구형 TRK(Tropomyosin receptor kinase) 억제제인 ‘비트락비(Vitrakvi; larotrectinib)를 후천성 내성 변이 없이 NTRK(Neurotrophic tyrosine receptor kinase) 유전자 융합을 가지는 소아 및 성인 고형암 환자의 치료제로 승인한 것이다.
NTRK유전자는 비정상적으로 TRK 융합단백질을 생성하는 유전자와 만나 NTRK유전자 융합을 형성한다. TRK 융합 단백질은 종양세포의 생존과 증식을 촉진하는 발암인자 역할을 한다. 이를 통해 나타나는 ‘TRK 융합 암’은 폐암, 갑상선암, 대장암, 교모세포종 등 고형암으로 체내 어디서든 발병할 수 있다.
2018년 마지막으로 승인된 신약은 알렉시온 파마슈티컬의 발작성 야간혈색소뇨증 치료제 ‘울토미리스(Ultomiris)’였다. 울토미리스는 당초 올해 2월 18일로 예정된 시기보다 빠르게 FDA로부터 조기 승인을 획득했다.
울토미리스는 2017년 가장 많이 팔린 희귀의약품 10개 가운데 환자 수 대비 가장 높은 매출을 올린 솔리리스(Solilis, Eculizumab)의 후속 약물이다. 두 약물은 같은 발작성 야간혈색소뇨증을 적응증으로 하는데 솔리리스는 2주 간격으로 투약해야 하는 반면, 울토미리스는 8주 간격으로 투약해도 같은 효과를 얻을 수 있어 환자 편의성 측면에서 더 뛰어나다.
FDA의 분석 결과를 살펴보면 허가 신약 가운데 56%가 희귀적응증 치료제였으며, 76%가 우선심사 대상이었다. 또한 24%가 혁신신약 지정약물이었으며 44%는 신속심사를 통해 승인됐다.
참고 : https://www.fda.gov/drugs/developmentapprovalprocess/druginnovation/ucm592464.htm


















