기업
美 FDA, 오상헬스케어 '코로나19진단' 긴급사용승인
기사입력 : 2020-04-19 16:39수정 : 2020-04-19 19:18
바이오스펙테이터 장종원 기자
국내 기업 최초 코로나19진단 EUA 획득
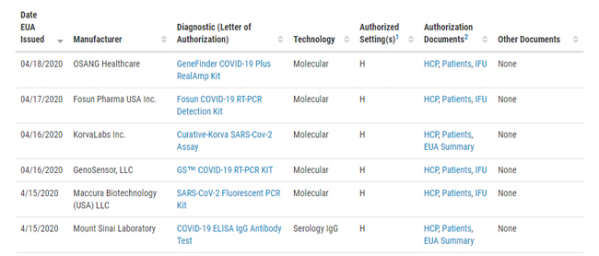
오상헬스케어의 코로나19 진단키트가 미국 식품의약국(FDA)으로부터 긴급사용승인(EUA)을 받았다. 국내 기업의 코로나19 진단키트로는 첫 EUA 획득이다.
FDA는 18일(현지시간) 홈페이지를 통해 오상헬스케어의 'GeneFinder COVID-19 Plus RealAmp Kit'를 긴급사용승인을 허용한다고 밝혔다.
오상헬스케어의 코로나19 진단키트는 실시간 중합효소연쇄반응법(RT-qPCR)을 통해 'SARS-CoV-2' 바이러스의 목표유전자 3종(E Gene, RdRp Gene, N Gene)을 정성 검출한다. FDA는 서한에서 "이번 EUA 승인은 코로나19 사태가 종식되기 전까지 유효하다"고 밝혔다.
앞서 외교부는 지난달말 국내 코로나19 진단키트 3개 업체가 FDA 긴급사용승인을 신청해 'Pre-EUA'를 받았다고 밝힌 바 있다. 오상헬스케어는 이중 가장 먼저 EUA를 받는데 성공했다.
오상헬스케어는 1996년 설립된 진단 의료기기 전문 회사기업으로 분자진단 제품을 비롯해 혈당측정기, 당화혈색소(HbA1c) 측정기, 콜레스테롤 측정기,인플루엔자 진단, 심장진단, 간질환진단 등의 제품을 개발, 판매하고 있다.


















