기업
제약ㆍ바이오업체들, '희귀의약품 지정'에 목메는 까닭
바이오스펙테이터 천승현 기자
희귀약 지정시 임상2상만으로 조건부 허가..개발단계 지정 가능하지만 임상 완료해야 시판 가능
바이오업체 알바이오가 줄기세포치료제 '바스코스템'의 희귀의약품 지정 여부를 두고 보건당국과 공방을 벌이고 있다. 알바이오는 바스코스템이 희귀의약품의 지위를 인정받아야 한다고 주장하지만 식품의약품안전처는 지금까지의 임상자료만으로는 부족하다는 입장이다.
알바이오 뿐만 아니라 많은 제약·바이오 업체들이 개발 중인 제품의 희귀의약품 지정 여부에 촉각을 기울인다.
막대한 자본이 투입되는 임상3상시험을 진행하지 않고도 임상2상시험 자료만으로 허가받고 빨리 판매할 수 있기 때문이다. 희귀의약품은 높은 약가를 받을 수 있다는 점도 매력이다. 국내에서 보험약가를 받은 의약품 중 가장 비싼 제품은 국내 바이오업체 안트로젠이 개발한 ‘큐피스템’으로 1회 투여 비용에 대한 보험약가가 무려 1349만원이다.
희귀의약품은 허가절차도 다른 신약에 비해 간단한 편이다. 희귀의약품은 허가받을 때 ‘제조·품질관리를 위한 기준 및 시험방법 자료’와 같은 복잡한 자료를 제출하지 않아도 된다. 안전성·효능을 입증하기 위한 임상시험도 다른 제품보다 수월하게 진행토록 하는 등 희귀의약품 개발 업체에 상당한 혜택이 주어진다.
단순히 환자수가 적다는 이유만로 희귀의약품으로 지정되지는 않는다. 식약처의 ‘희귀의약품 지정에 관한 규정’을 보면 희귀의약품은 국내 환자수(유병인구)가 2만명 이하인 질환에 사용된다는 필수 요건을 충족해야 한다. 여기에 적절한 치료방법과 의약품이 개발되지 않은 질환에 사용하거나 기존 대체의약품보다 현저히 안전성 또는 유효성이 개선됐다는 기준을 인정받아야 한다.
국내에는 현재 총 217개 성분이 희귀의약품으로 지정된 상태다.
바스코스템의 경우 식약처는 ‘유병인구 2만명 이하(버거병 환자 4700여명)' 요건만 충족했을 뿐 나머지 기준은 충족하지 못했다고 판단했다. 바스코스템이 임상시험에서 대체의약품보다 우수하다는 점을 입증하지 못했다는 이유로 희귀의약품 지정이 불가능하다는 설명이다. 현재 논란 중인 희귀의약품 지정 여부는 임상시험을 완료한 이후 시판승인을 목표로 한 허가절차를 의미한다.
제약기업들은 임상시험이 마무리되지 않아도 미리 희귀의약품으로 지정받을 수 있다. '개발단계 희귀의약품'으로 불리는데 약리기전이나 비임상 시험 등으로 볼 때 기존 대체의약품(희귀의약품으로 지정·허가된 의약품 제외)보다 현저히 안전성 또는 유효성 개선이 예상되는 경우 임상시험 단계에서도 희귀의약품으로 지정될 수 있다.
개발단계에서 미리 희귀의약품으로 지정됐다고 판매가 가능하다는 의미는 아니다. 임상시험을 완료한 후 허가절차를 거쳐야만 판매할 수 있다.
바스코스템의 미국 식품의약품국(FDA) 희귀의약품 지정이 ‘개발단계 희귀의약품’에 해당한다. 알바이오는 지난달 FDA로부터 바스코스템의 임상1상시험 자료를 근거로 희귀의약품 지정을 받았지만 판매는 불가능하다. 알바이오는 미국에서 바스코스템의 임상2상을 진입하고 시판허가를 신청할 계획이다. 국내에서 논란 중인 희귀의약품 지정은 조건부 승인을 전제로 한 희귀의약품 지정이고 미국에서의 지정은 개발단계 희귀의약품 지정이다.
김상봉 식약처 의약품정책과장은 “알바이오는 미국에서 개발단계 희귀의약품으로 지정받고 추가 임상시험을 하겠다고 하는데 국내에서는 같은 자료로 사실상 시판을 하겠다는 주장을 펼치고 있다”고 설명했다. 만약 알바이오가 추가 임상시험을 진행하겠다는 조건을 걸고 개발단계 희귀의약품을 신청하면 지정이 가능할 수도 있다는 게 식약처 견해다.
국내에서는 차바이오앤디오스텍의 ‘동종 배아줄기세포유래 망막새소상피세포’, 메디포스트의 ‘동종 제대혈유래 중간엽줄기세포’ 등 10개 성분이 개발단계 희귀의약품으로 지정됐다.
희귀의약품 지정 이후 임상2상 자료만으로 승인을 받더라도 일정 기간내 임상3상시험을 수행해야한다는 조건이 붙는다.
식약처는 지난 2003년 CJ헬스케어(당시 CJ제일제당)이 개발한 슈도박신주를 희귀의약품으로 지정하고 6년 이내에 3상 임상시험 성적자료를 제출하는 조건으로 `국산신약 7호`로 허가했다. CJ헬스케어는 2005년 `녹농균 감염에 의한 패혈증 및 낭포성 섬유증 환자의 예방·치료를 위한 임상시험` 연구에 착수했지만 피험자가 부족하다는 이유로 임상시험을 중도 포기했고 결국 2009년 슈도박신의 허가를 자진 취하했다.
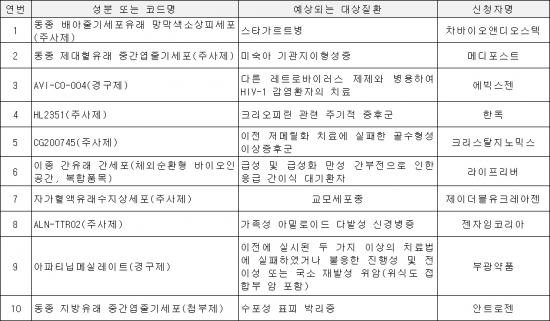
▲개발단계 희귀의약품 지정 현황(자료: 식품의약품안전처)


















