기업
3.5년간 임상시험 개시 2230건 실패는 166건..전부일까
바이오스펙테이터 천승현 기자
임상시험 조기종료 보고 현황..임상 성공률 90%↑ 추정ㆍ중단 사실 은폐 지적 제기
지난 2013년부터 3년 6개월 동안 의약품 임상시험을 중도에 중단했다고 보고된 건수는 총 166건으로 나타났다. 같은 기간 임상시험 계획 승인 건수의 7%에 불과한 수치다. 업계 일각에서는 국내 업체들이 사실상 실패에 결론난 임상시험을 지속하거나 임상 중단 사실을 은폐하는 것 아니냐는 의혹을 제기한다.
20일 식품의약품안전처가 국회에 제출한 임상시험 중단현황 자료에 따르면, 지난 2013년부터 올해 6월까지 의약품 임상시험을 조기 종료했다고 접수된 건수는 총 166건으로 나타났다. 신약·개량신약 등의 개발을 목표로 임상시험에 착수했지만 당초 세운 목표를 달성하지 못하고 임상시험을 중도에 포기하고 정부에 이 사실을 보고한 사례다.
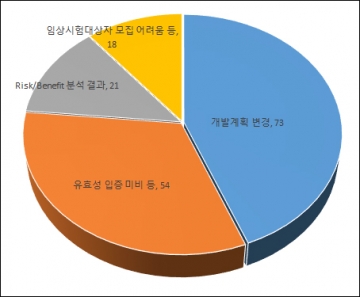
▲2013~2016.6 임상시험 중단현황(자료: 식품의약품안전처)
임상시험 중단 사유별로 살펴보면 개발계획 변경으로 임상시험을 중단한 경우가 73건으로 가장 많았다. 임상 대상 의약품의 유효성 입증 미비로 중도 포기를 선언한 임상시험도 54건에 달했다.
시장성이 낮거나 부작용이 발생하는 등(Risk/Benefit 분석 결과)의 사유로 21건의 임상시험이 조기에 접었고 임상시험 대상자 모집이 어려워 중단된 임상시험은 18건으로 조사됐다.
같은 기간 식약처로부터 승인받은 임상시험 계획은 총 2230건(2013년 607건, 2014년 652건, 2015년 675건, 올해 상반기 296건)으로 집계됐다. 임상시험 승인 건수 대비 임상시험 중단 보고 건수의 비율이 7.4%에 불과한 셈이다.
지난 2010년부터 3년 동안(2010년 439건, 2011년 503건, 2012년 670건)에도 매년 500건 이상의 임상시험이 새롭게 착수한 것을 감안하더라도 실제 임상시험 진행 건수 대비 중단 보고 비율은 10%에도 채 못 미친다는 계산이 가능하다. 제약사나 바이오기업들이 중도에 포기한 임상시험을 모두 정부에 보고했다면 국내에서 진행된 임상시험의 성공률이 90%를 웃돈다는 얘기가 된다.
업계 일각에서는 임상시험 실패로 조기 종료된 건수에 비해 식약처에 보고된 임상 중단 건수가 현저히 적을 수 있다는 의혹을 제기한다. 임상시험에 실패하고도 보고하지 않은 사례가 적지 않다는 시각이다.
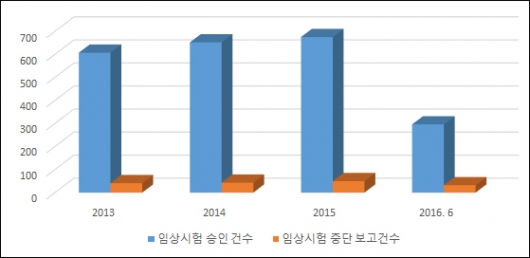
▲2013~2016.6 임상시험 승인 건수 및 임상시험 중단 건수(단위: 건, 자료: 식품의약품안전처)
미국바이오협회가 지난 6월 발행한 임상단계별 성공률(Clinical Development Success Rates 2006~2015)에 따르면 모든 의약품 후보물질의 임상1상부터 품목승인까지의 성공률은 9.6%에 그쳤다. 임상 1상 성공률과 2상 성공률은 각각 63.2%, 30.7%로 조사됐다. 임상3상 성공률은 58.1%로 나타났다.
업계 한 관계자는 “다양한 신약 과제를 동시다발로 진행하는 다국적제약사와는 달리 국내제약사나 바이오벤처들은 일부 신약개발에 집중하기 때문에 임상시험 실패를 인정하지 않는 분위기가 팽배하다”고 지적했다.
임상시험 진행 과정에서 당초 목표에 도달하지 못했거나 시장성이 불투명하다고 결론 났는데도 임상시험을 중단하지 않고 마지막까지 끌고 가는 경향이 많다는 시각이다.
2013년부터 올해 상반기까지 임상시험 조기 종료를 보고한 제약사 중 한국노바티스(10건), 한국MSD(9건), 글락소스미스클라인(8건) 등 다국적제약사가 상위 1~3위를 차지했다.
사실상 임상시험 실패를 확인하고도 투자자들의 투자 심리 위축 등을 우려해 중단 사실을 보고하지 않는 사례도 적지 않을 것으로 추측된다.
이에 대해 환자들과 투자자들의 정보 접근성을 위해 임상시험 중단 여부도 공표해야 한다는 지적이 나온다. 미국 보건부(HHS)와 국립보건원(NIH)은 임상시험 실패 사실을 보고하지 않을 경우 연구비 지원을 중단하는 정책을 시행할 계획이다.



















