국제
크리스퍼 유전자교정 통한 "시력회복 가능성 확인"
바이오스펙테이터 김성민 기자
솔트 연구팀, 네이처에 발표.."세포분열 끝난 망막세포에 유전자 도입, 망막질환 동물모델 시력회복 확인"
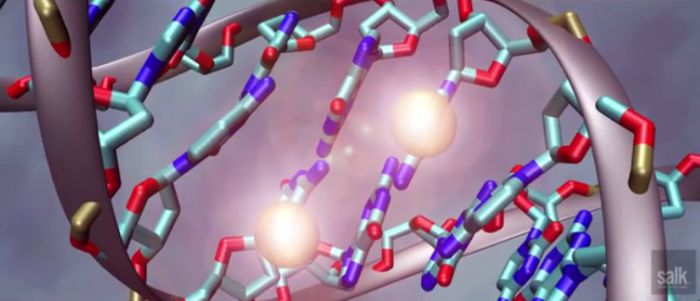
▲출처: Salt 연구소 동영상 자료
크리스퍼 유전자 가위(CRISPR-Cas9)의 치료가능성에 새로운 장이 열리고 있다. 미국 솔트연구소 연구팀은 유전자가위로 ‘세포분열이 끝난 망막세포'에서 유전자를 삽입해 쥐에서 시력을 회복하는 연구결과로 학계의 주목을 받고 있다. 연구팀은 네이처에 "In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration"란 제목으로 16일 논문을 게재했다.
크리스퍼는 일반적으로 피부와 같이 세포분열이 계속적으로 일어나는 세포에서 가장 효과적으로 작용한다고 알려져 있다. 이와 같은 원리를 적용한 크리스퍼 시스템으로 동물모델에서 희귀빈혈증, 혈우병, 암을 치료를 하는 연구결과가 속속 발표되고 있는 추세다. 또한, 지난달 28일 중국 쓰촨대 박사팀은 세계 최초로 인간 T세포를 채취, 유전자가위로 면역관문 유전자 PD-1 제거, 증식한 후 다시 암환자에게 주입한 임상시험을 시작해 화제가 됐다.
반면, 솔트 연구팀은 세포분열이 끝난 망막세포에 바이러스 운반을 통한 치료용 유전자를 유전자 가위로 삽입해 망막색소변성증(retinitis pigmentosa)을 가진 동물모델에서 시력이 회복되는 것을 확인했다. 연구팀은 NHEJ(non-homologous end-joining)과 크리스퍼 시스템을 이용해 ‘유전체의 매우 정확한 부위에 원하는 치료용 DNA를 도입하는 방법’을 이용했다.
Jun Wu 수석연구자는 솔트연구소 영상자료에서 “이번 연구가 중요한 이유는 ‘성숙한 성인’에게 (유전자가위의) 적용가능성을 보여줬기 때문이다. 성인의 대부분의 세포는 분열이 중지된 상태”라고 강조했다. 한편 망막색소변성증은 유전적 요인으로 발병해 성장하면서 점차 시력이 손상되는 질환으로 연구팀이 타깃한 부위는 빛을 감지하는 세포가 분포하는 눈 뒤쪽에 분포하는 망막조직이다.
현재 전세계적으로 크리스퍼를 이용해 세포분열이 끝난 뇌, 심장, 췌장을 포함한 관련 질환을 치료하려는 움직임이 활발하다. 동물 뇌세포에서 크리스퍼 시스템을 이용해 유전자 교정을 한 연구결과가 발표된 바가 있으며, 유전자가위는 뇌혈관장벽을 통과하지 못하기에 두개골을 통과해 바이러스를 통해 직접 주입하는 방법이 쓰이고 있다.
이와 유사한 움직임이 국내에도 있다. 툴젠은 안정적인 바이러스 벡터인 AAV를 통해 크리스퍼를 간세포에 전달, 간유전자 치료를 통해 내부유전체를 바꿔 희귀병을 치료하는 방법을 연구∙개발 중이다. 툴젠은 혈우병과 같이 단백질 대체치료 중인 희귀 유전질병 치료를 목표로 하며, 망막질환 치료도 활발히 연구 중이다.
김진수 기초과학연구원 단장은 “NHEJ 기술은 유전자를 정확한 삽입하기 위해 학계에서 널리 쓰이고 있는 방법으로 솔트 연구팀의 접근방법은 치료용 유전자를 정해진 위치에 넣는 것이 목적이다”라며 “반면 툴젠은 내부 유전체를 바꿔 치료하는 방법으로 실제 환자에게 적용했을 땐 간을 통한 유전자교정 방법이 더 용이하다”라고 전했다.

















