국제
주목받는 ‘신약 재창출’ 전략..말초신경병증 치료가능성 확인
바이오스펙테이터 조정민 기자
샌디에이고 의과대학 연구진, M1R 억제를 통해 증가된 신경 재생 결과 얻어

신경세포의 신경돌기(neurite) 증식과 재생에 관여하는 새로운 분자 신호전달 경로를 밝히고 '신약 재창출(Drug repositioning)' 방식을 통해 빠른 임상적 적용이 가능한 말초신경병증의 치료법이 제시됐다. 신약 재창출 전략은 이미 시판 중이거나 임상 단계에서 안전성이 검증된 약물을 새로운 기전으로 활용하는 방식이다.
샌디에이고 의과대학 연구진은 미국 NIDDK(National Institute of Diavates and Digestive and Kidney diseases)와 캐나다의 마니토바 대학교, 세인트 보니페이스 병원 등의 연구자와 함께 진행한 세포실험과 동물실험을 통해 신경전달물질 아세틸콜린의 무스카린성 수용체가 신경세포의 신경돌기 증식과 성장에 관여한다는 것을 밝혔다. 이 연구결과는 지난 17일 국제학술지 ‘Journal of Clinical investigation’에 게재됐다.
말초신경병증(Peripheral neuropathy)은 말초신경계의 손상으로 발생하는 질환으로 손발 저림, 아린감, 근육약화부터 심각한 통증, 마비, 장기의 불능까지 넓은 범위의 증상이 나타난다. 미국의 경우 2000만명 가량이 1/2형 당뇨병, HIV, 화학적 항암치료의 부작용으로 인한 말초신경병증으로 고통받고 있다.
연구진은 감각신경의 성장과 재생에 이용되는 핵심적인 분자와 메커니즘을 찾기 위해 노력했고 신경세포체에서 다른 신경세포와 연결되기 위해 뻗는 신경돌기(Neurite)의 증식이 무스카린성 아세틸콜린 수용체의 활성에 의해 억제된다는 사실을 관찰했다. 세포의 활성화와 관련된 신경전달물질인 아세틸콜린의 수용체 중 한 분류인 무스카린성 수용체(Muscarinic receptor; MR)는 신경세포, 심근, 선세포 등에 많이 분포하며 활성화되면 세포내의 칼슘농도 상승과 칼슘채널을 막는 역할을 한다.
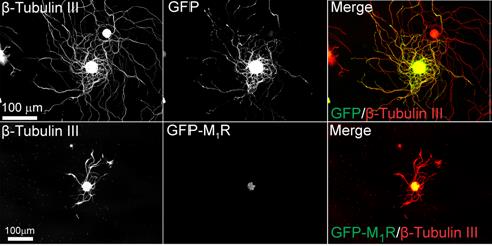
▲M1 Receptor를 과발현시킨 신경세포와 정상 신경세포의 신경돌기 증식과 성장을 비교한 결과, 과발현된 세포의 신경돌기 성장이 억제된다는 사실을 확인. 출처: Selective antagonism of muscarinic receptors is neuroprotective in peripheral neuropathy. The journal of clinical investigation. 2017. Nigel A.Calcutt et al.
이들은 무스카린성 1형 수용체(M1R)를 과도하게 발현시킨 신경세포가 대조군의 신경세포과 비교했을 때 신경돌기의 증식과 성장이 억제된다는 사실을 확인했다. 또한 무스카린성 수용체가 결핍된 동물모델에서 신경돌기의 증식과 성장이 더 높다는 실험결과를 얻었다. 이러한 결과를 토대로 무스카린성 수용체의 활성 여부가 신경세포 재생과 성장에 영향을 미친다는 것을 확인했다.
연구진들은 이미 제품허가를 받아 임상에서 사용하고 있는 항무스카린성제제(anti-muscarinic drug) 성분을 당뇨병 마우스모델에게 적용한 결과, 미토콘드리아의 기능 부전이 극복되는 결과를 얻었다. 미토콘드리아는 에너지 전달물질인 ATP를 생성하는 세포 소기관으로 손상된 신경세포의 재생에 중요한 역할을 한다는 이전의 연구 보고들이 존재한다.
이 연구를 통해 과학자들은 이미 다른 질병의 치료를 위해 승인받은 항무스카린제제를 말초신경병증 치료제로 사용할 수 있다는 가능성을 제시한다. 연구를 공동 진행한 캐나다 마니토바 대학의 폴 베니허(Paul Fernyhough) 교수는 “우리가 확인한 결과는 유럽에서 20년 이상 다양한 기전들에 대한 임상적용으로 안전성이 잘 밝혀져 있는 항무스카린제제가 새로운 치료제로 전환이 가능하다는 것을 보여주는 것으로 매우 고무적”이라며 “기존 약물의 용도 변경을 통한 새로운 치료제의 개발은 임상 과정을 생략할 수 있어 빠른 시장 도입이 가능하다”고 말했다.
이미 시판 중이거나 임상 단계에서 안전성이 검증된 약물을 새로운 기전으로 활용하는 ‘신약 재창출’ 전략은 신약개발기간을 획기적으로 단축시킬 수 있다. 후보물질 발굴이후 안전성을 확인하는 임상 1상까지 평균 7-8년의 시간이 소요되는데, 안전성과 독성에 대한 1차 확인이 완료된 기존 약물을 사용함으로써 이 과정이 생략이 가능하다는 장점이 있어 여러 신약개발회사가 이 전략을 선택하고 있다.
대표적인 사례로는 화이자의 폐암치료제 '잴코리'가 있다. 화이자는 2005년 ALK 억제물질을 개발하고 임상 1상을 진행했다. 임상 1상 말미에 폐암에서 EML4-ALK융합유전자를 발견해 신약재창출 전략을 통해 비소세포폐암을 적응증으로 하는 맞춤항암제로 개발, 2011년 승인허가를 받았다.
국내 기업에서는 ‘지피씨알(GPCR)’이 신약 재창출을 핵심 전략으로 내세웠다. 이들은 이형중합체(heterodimer)형태로 존재하는 G단백질 연결수용체를 타깃으로 맞춤 항암제 연구를 진행하고 있다. 타깃 수용체와 중합체를 형성하고 있는 수용체에 작용하는 기존 약물에 대한 스크리닝 과정을 통해 ‘우회-효과(indirect-effect)’에 가장 적합한 후보약물을 찾음으로써 간접적인 방법으로 원하는 치료효과를 나타낼 수 있는 새로운 개념의 신약 개발을 하고 있다. 회사 측은 ‘신약 재창출’을 이용해 전략적인 개발을 진행, 빠른 시일 내 임상 2상으로의 진입을 목표로 하고 있다.


















