기업
'美 임상 재도전' 녹십자의 혈우병치료제 차세대 버전은?
바이오스펙테이터 박준범 기자
녹십자, 후보물질 2개 신규 R&D 파이프라인 추가..2019년 임상 목표
지난해 10월 녹십자는 갑작스러운 결단을 내렸다. 지난 2012년부터 진행 중이던 유전자 재조합 A형 혈우병 치료제 ‘그린진에프’의 미국 임상3상시험을 중단키로 결정했다. 이미 4년간 미국 임상시험을 진행하며 적잖은 비용을 투입했다는 점에서 쉽지 않은 결정이었지만 현실을 고려한 판단이었다.
혈우병이라는 희귀질환 특성상 환자 수가 제한적인 상황에서 후속 약물의 등장으로 성공적으로 임상시험을 종료했더라도 상업성을 낙관할 수 없다는 이유가 컸다. 이미 미국 시장에는 바이오젠, 박스앨타 등이 기존 치료제보다 약효 지속 효과가 1.5배 이상 늘어난 후속 약물이 등장한 상태다.
녹십자 측은 당시 "경쟁 약물보다 최대 2배(기존약물 대비 3배) 지속되는 혈우병치료제를 개발 중이다. 개발 속도를 끌어 올려 미국 시장에 재도전할 계획이다"라고 약속했다. 그로부터 4개월이 지났다. 이 시점에서 녹십자는 새로운 혈우병치료제 후보물질 2개를 공개했다.
7일 업계에 따르면 녹십자는 새로운 혈우병치료제 후보물질 ‘MG1121A’와 ‘MG1113A’를 연구개발(R&D) 파이프라인에 새롭게 추가했다. ‘MG1121A’는 지속형 혈우병 치료제이며, ‘MG1113A’는 새로운 기전인 조직인자계 응고억제제(Tissue Factor Pathway Inhibitor, TFPI)를 저해하는 항체 혈우병치료제다. 두 후보물질 모두 미국 시장에서 고배를 든 그린진에프의 넥스트 버전인 셈이다.
녹십자가 공개한 R&D 자료를 보면 이번에 발표한 ‘MG1121A’는 지속형 혈우병 치료제로 후보물질 탐색단계를 거쳐 전임상시험 단계가 진행 중이다. MG1121A는 경쟁 약물로 평가되는 3개의 4세대 지속형 혈우병치료제 대비 긴 반감기를 가질 것으로 기대되는 약물이다.
박스앨타의 ‘아디노베이트’와 바이오젠의 ‘엘록타’는 각각 주 2회, CSL베링의 ‘앱스틸라’는 주3회 투여하는 혈우병치료제다. 앱스틸라는 SK케미칼이 기술수출했다.
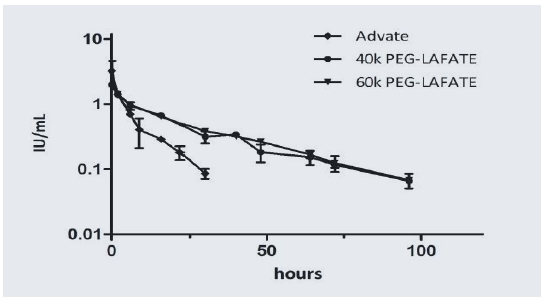
▲MG1121A 전임상 약동력학(PK) 결과(녹십자)
MG1121A는 전임상시험에서 혈중 약물 농도가 절반으로 줄어드는데 걸리는 반감기가 비교 약물 아디노베이트보다 3.3배 긴 것으로 나타났다. 주1회 투여 약물의 가능성이 확인됐다. 녹십자는 오는 2019년 미국에서 임상1상시험 진입을 목표로 하고 있다.
MG1121A는 기존 치료제에 비해 다른 기술이 적용됐다. 엘록타와 앱스틸라는 반감기를 늘리는 방법으로 Fc융합을 선택했다. 엘록타는 면역글로블린(Ig)단백질의 고정부위(Fc, 항체 아랫부분)를 붙였고, 앱스틸라는 접합부위에 엔-글리코실레이션(N-glycosylation)을 첨가했다. 아디노베이트는 폴리에틸렌글리콜(Polyethylene glycol, PEG)을 붙이는 페길화(PEGylation) 방법을 적용했다.
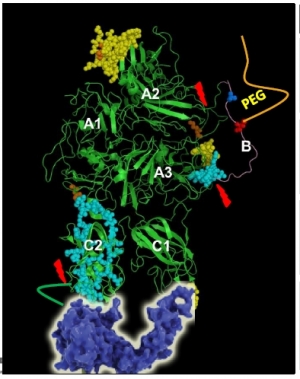
▲지속형 혈우병치료제 MG1121A 구조(녹십자 )
이에 반해 MG1121A는 기존 제품이 비해 진보된 능력을 갖추기 위해 △단일사슬(single chain) △본빌레브란트 △페그 등 다양한 기술을 적용했다.
단일사슬(single chain)을 써서 단백질의 구조 및 생체내외에서 안정성을 증가시켰다는 설명이다. 본빌레브란트인자(vWF, von Willebrand Factor)를 D영역(domain)에 붙여서 본빌레브란트가 분해되는 것을 억제했다. 본빌레브란트인자는 혈소판의 부착에 관여하는 인자인 동시에 제8혈액응고인자를 안정화시키는 단백질이다.
면역원성을 최소화 하기 위해서 페길화 기술을 위한 페그(PEG)를 B영역에 접합했다. 페그는 단백질의 반감기를 늘려주는 역할도 한다. 제8혈액응고인자와 유사한 형태를 지니게 하기 위해 단백질조작(Fc Engineering)을 한 D영역과 B영역을 쪼갤 수 있는 링커(cleavable linker)를 썼다. B영역의 링커는 출혈시 트롬빈에 의해 쪼개진다.
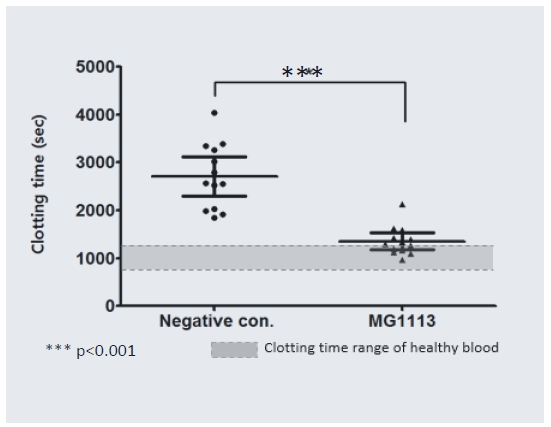
▲MG1113A 전임상 혈액응고 소요시간 결과(녹십자)
MG1113A는 새로운 기전인 조직인자계 응고억제제(Tissue Factor Pathway Inhibitor, TFPI)를 저해하는 항체 혈우병치료제다
조직인자계 응고억제제는 제7,10혈액응고인자에 결합해 혈액응고를 방해한다. 조직인자계 응고억제제가 혈액응고를 방해 못하도록 억제하는 방식으로 혈액이 원활하게 응고될 수 있도록 유도하는 약물기전이다.
MG1113A의 동물실험 결과를 보면 혈우병 혈액이 응고 시간이 정상혈액 수준에 근접한 것으로 나타났다. MG1113A 투여한 혈액이 혈우병혈액(2800초) 대비 절반수준(1300초)으로 감소했다. 혈우병 A환자의 증상 개선 또는 기존 치료제 내성 환자를 대상으로 주1회 피하주사 투여하는 약물로 개발하기 위해 2019년 미국 임상 1상시험을 계획 중이다.
녹십자 관계자는 “이번 발표한 차세대 혈우병치료제 2개중 하나는 지속형으로 몸속에 부족한 단백질을 채우고 하나는 단백질 기능 차단시키는 기전을 가지고 있다. 혈액사업과 시너지를 낼 수 있는 다양한 파이프라인을 개발할 것이다“고 전했다.


















