오피니언
[기고]차세대 I-O, 신항원 암 백신 5가지 포인트
지현배 면역학 박사
신항원 종양백신 연구개발&투자 트렌드는?..韓바이오텍 우수한 RNA/DNA 분석기술+병원의 임상경험= 기회 엿볼 수 있어

▲지현배 면역학 박사(현재 Ambrx)
2018년 노벨 의학상은 CTLA-4 저해제(inhibitor)의 항암작용을 밝혀낸 제임스 앨리슨(James P. Allison) 박사와 PD-1 역할을 처음으로 규명한 혼조 다스쿠(Tasuku Honjo) 박사에게 수상되었다. 이들은 면역관문억제제(immune checkpoint inhibitors, ICIs)를 통해 T세포의 기능을 향상시킴으로써 종양을 제거할 수 있음을 보여주었고 면역항암제(Immuno-oncology, I-O) 개념을 암환자를 치료하는데 성공적으로 적용한 공로를 인정받았다.
현재 면역관문억제제를 이용한 치료는 다양한 병용요법들과 함께 여러 암종을 치료하는 임상에서 광범위하게 사용되고 있다. 흥미로운 것은 면역관문억제제에 상대적으로 높은 반응을 보이는 암종은 그렇지 않은 암종에 비해 종양 돌연변이 빈도 (tumor mutation burden, TMB)가 높은 현상이 관찰되었다. 이러한 현상은 종양이 증식할 때 돌연변이가 발생하고 이 돌연변이가 발현되면 T세포를 자극할 수 있는 신항원(neoantigen)이 형성되는 현상과 연관성이 있다. 즉, 종양에서 형성된 신항원은 T세포를 자극하고 자극된 T세포는 면역관문 수용체(immune checkpoint receptors)의 발현이 유도되어 그 항암작용이 억제된다. 면역관문억제제는 이렇게 억제된 T세포를 다시 활성화시킴으로 종양을 효과적으로 제거할 수 있도록 도와주는 것이다.
면역관문억제제를 사용한 임상에서 관찰된 결과를 바탕으로 1)암 백신으로서 신항원 개발, 2)신항원과 면역관문억제제의 병용 치료법 개발, 3)신항원을 인지하는 T cell receptor(TCR)을 이용한 T세포 치료제 개발이 본격화되는 계기가 되었다. 특히 소규모 임상 결과를 통해 위 3가지 치료법의 임상적 잠재성이 확인되었고 최근 이들 분야에 대한 집중적인 연구와 투자는 현저히 늘어나고 있는 추세이다.
본말
이번 기고문은 최근의 신항원 암 백신 개발에 대한 연구및 투자 경향을 살펴보고 다음에 기술된 5가지 관점들을 통해 관련 분야에 관심이 있는 독자들이 차세대 면역항암제로서 신항원 종양 백신에 대한 이해의 폭을 넓힐 수 있는 계기를 마련하고자 한다.
1) 신항원은 종양에서만 발현하고 T 세포들은 이를 선별적으로 인지할 수 있기 때문에 신항원을 이용한 종양 백신은 가장 면역학적인 약물들 중 하나다.
종양은 증식할 때 DNA 돌연변이가 발생하는데 이 돌연변이가 발현되면 T세포를 자극할 수 있는 면역 자극성의 신항원이 형성된다. 따라서 신항원은 정상적인 세포에서는 발현되지 않고 종양세포에서만 선별적으로 발현되기 때문에 이를 인지하는 T세포는 종양 세포만을 구별하여 공격할 수 있다. 이러한 현상은 바이러스에 감염된 세포들에서 발현된 바이러스 항원들을 T세포들이 인지하여 선별적으로 제거하는 현상과 유사하기 때문에 신항원을 이용한 백신은 가장 면역학적인 약물들 중 하나가 될 수 있다.
암 백신 개발은 종양을 치료하기 위한 새로운 분야가 아니다. 그러나 이전에 개발된 암 백신은 종양에서 주로 과다 발현되지만 정상적인 세포에서도 낮게 발현되는 항원들이었다(그림 1). Tumor-specific antigen, cancer-testis antigen, over expressed tumor antigen이 그 예가 될 수 있다. 즉, 이러한 항원들은 정상 세포에서도 발현되기 때문에 이를 자극하는 T세포는 종양 세포뿐 아니라 정상 세포도 공격할 수 있다. 따라서 이러한 종양 항원들은 자가면역 질환과 같은 부작용을 발생시킬 잠재적인 위험성을 갖고있다. 이러한 면에서 기존의 암 백신들과 비교해 볼 때 신항원을 이용한 백신은 이를 자극하는 T 세포를 통해 종양만을 선별적으로 제거하기 때문에 안전성과 효능면에서 우수할 것으로 판단된다.
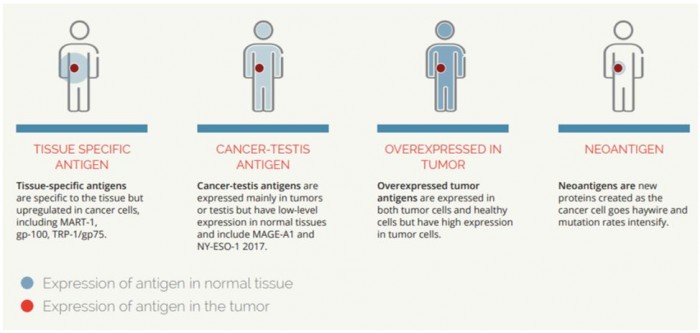
▲종양에서 선별적으로 발현되는 신항원(neoantigens)
신항원(neoantigens)은 ‘public neoantigens’ 과 ‘private neoantigens’으로 구분될 수 있다. Public neoantigens은 많은 환자들의 종양들에서 반복적으로 공유된 신항원으로서 암의 발생을 유도하는 유전자 돌연변이의 발현으로 인해 형성되는 것으로 알려져 있다. 이러한 돌연변이 유전자를 갖고 있는 환자들의 경우 public neoantigens은 ‘off-the-shelf’ 개념의 백신으로 개발될 수 있고 이를 발현하는 환자들을 치료하는데 사용될 수 있다(1).
환자가 public neoantigens을 갖고 있지 않은 경우 private neoantigens을 동정할 필요성이 있다. Private neoantigens을 동정하기 위해서는 종양 전체의 시퀀스를 통해 유전자 돌연변이를 분석하고 이들 중 T세포를 자극하는 신항원을 동정해야 하는데 이 과정은 매우 복합적이다. 또한 경제적인 면에서 고비용이 들어가고 임상에서 실패할 수 있는 어려운 점이 있다. 그러나 다양한 분석 방법들이 빠르게 발전되고 있고 좀 더 정밀한 방법을 통해 private neoantigens을 동정하는데 걸리는 시간과 비용적 문제들을 해결하는 방법들이 개선될 것으로 예상된다.
성공적인 신항원 종양백신 개발을 위해서 그 효능을 저해할 것으로 예상되는 요소들도 고려해야 한다. 즉, 1)면역 억제적인 면역 세포들(regulatory T cells 과 MDSC)과 사이토카인들이 분비되는 종양 미세 환경, 2)항원처리 단백질이나 항원을 제시하는 major histocompatibility complex (MHC)의 발현을 낮추는 종양에서 발현되는 요소들, 3)종양의 이질성(tumor heterogeneity)으로 인한 항원 자극성(antigenicity)의 손실들이 그 예들이다.
2) 차세대 염기서열 분석법(Next gene sequencing, NGS)과 같은 빅데이터의 처리, 신항원 예측(neoantigen prediction)을 위한 인공지능(artificial intelligence, AI) 개발과 면역학적인 에세이 방법 및 기술의 발전은 신항원 종양 백신 개발을 가속화시키고 있다.
일반적으로 종양 샘플을 이용하여 whole-exome sequencing(WES)와 RNA sequencing을 통해 nonsynonymous mutations이 동정된다. 이렇게 동정된 돌연변이는 MHC binding prediction 프로그램을 통해 T세포를 효율적으로 자극할 수 있는 신항원 후보들이 선정된다. 현재 암 백신으로서 신항원이 갖고 있는 잠재성으로 인해 MHC binding prediction 모델은 매우 활발하게 개발되고 있다. 따라서 향후 NGS 기술과 MHC binding prediction 모델은 신항원 암 백신 개발에서 핵심적인 두 축이 될 것으로 전망된다. 바꿔말하면 IO 분야에서 NGS 기술 관련분야는 MHC binding prediction 모델과 연결될 때 그 기술과 데이터의 임상적 활용면에서 더 큰 의미를 갖게될 것으로 전망된다.
위에서 기술한 바와 같이 빅데이타 분석과 컴퓨터 프로그램의 눈부신 발전으로 유전자 돌연변이와 신항원을 동정하는 일이 컴퓨터 시뮬레이션과 같은 가상 환경에서 이루어지고 있다(in silico). 이와 관련된 방법들과 기술적인 복합성으로 인해 신항원을 동정하는 과정은 궁극적으로 인공지능으로 통합될 것으로 판단된다.
위에서 언급된 접근법들은 임상적 활용면에서 잠재성을 갖고 있지만 예측 알고리즘으로 동정된 신항원들 중 환자에서 항종양 면역반응을 자극할 수 있는 것은 매우 제한적이다(2). 따라서 이렇게 동정된 신항원들은 환자의 T세포들이 반응하는 지를 확인해야 비로서 암환자들을 치료하는 백신으로 사용될 수 있다. 예를들어, 선정된 신항원 후보들은 항원 형태로 환자의 T 세포의 증식 혹은 사이토카인 분비와 같은 T세포의 반응성 정도를 확인한 후 환자에게 투여될 최종 신항원 종양 백신이 결정된다.
또 다른 중요한 접근법은 신항원을 인지하는 T cell receptor(TCR)를 동정하거나 tumor infiltrating lymphocytes(TILs)를 사용하는 것이다. 즉 신항원에 반응하는 T세포의 TCR 유전자를 클론함으로 이를 다른 T세포에 발현시켜 T세포 치료법(TCR-T cell therapy)으로 사용하거나 신항원을 인지하는 TILs를 종양에서 분리한 후 증식시켜 환자에게 투여하는 방법이다. 반면에 CAR-T 세포 치료제는 종양 표면에서 과다 발현된 항원들을 타깃하는데 이들 항원은 종양 세포이외에 정상적인 세포에도 발현되는 점이 임상적 활용측면에서 제한성이되고 있다. 또한 종양 표면에서만 선별적으로 발현하는 타깃의 수가 매우 제한적이기 때문에 새로운 타깃 단백질을 동정하는 것이 어렵다는 것도 CAR-T 세포 개발에서 장애물이 되고 있다. 그러나 신항원을 인지하는 TCR-T 세포나 TILs 은 종양 표면뿐 아니라 종양 내부의 항원들을 타깃화할 수 있다. 즉, 종양 내부에서 유도되는 돌연변이 유전자들의 발현으로 형성된 신항원을 타깃화할 수 있다. 또한 CAR-T 세포와 비교해 볼 때 신항원을 인지하는 T 세포는 종양세포만을 선별적으로 공격하기 때문에 정상세포를 공격함으로 발생되는 부작용을 피할 수 있는 분명한 장점이 있다.
3) 신항원 백신 개발은 면역관문억제제의 효능을 높이는 병합치료법으로서 그 임상 시도가 최근 현저히 증가하고 있다.
면역관문억제제를 포함하는 대부분의 I-O 약물들은 신항원을 인지하는 T세포의 기능과 수를 향상시킴으로 그 효능이 결정된다고 할 수 있다. 또다른 한편으로 tumor mutational burden이 높은 hot tumor 일수록 신항원으로 자극되는 T세포의 빈도가 높기 때문에 면역관문억제제에 대한 반응율이 높다(그림 2). Hot tumors는 cold tumor에 비해 돌연변이의 발생이 높기 때문에 더 많은 수의 신항원이 형성된다. 또한 동일한 암종이라할지라도 몇몇 환자들은 다른 환자들에 비해 돌연변이 발생 빈도가 높고 이에 따라 면역 자극적인 신항원이 광범위하게 형성된 경우 면역관문억제제에 대한 반응이 높은 것으로 보고 되었다(3,4).
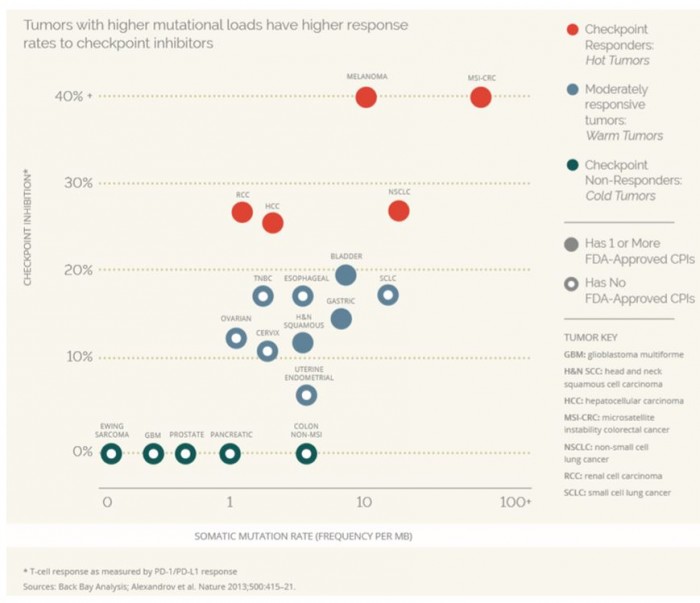
▲Somatic mutation 발생빈도와 immune checkpoint inhibitors 반응간의 연관성
돌연변이로 인해 높은 빈도의 신항원이 존재하는 hot tumor로 분류되는 흑색종 환자를 대상으로 한 임상에서 신항원 백신의 치료적 잠재성이 확인되었다. 다음과 같은 3개의 소규모 임상에서 예측모델을 이용하여 동정된 개인 맞춤형의 신항원 백신을 이용한 단일 치료나 면역관문억제제와의 병용 치료를 통해 그 임상적 효능의 잠재성이 확인되었다.
첫번째 연구에서는 예측 모델을 이용하여 20개의 private neoantigens으로 구성된 펩타이드 백신이 6명의 환자에게 주사되었다. 이들 중 생존한 4명의 환자는 25개월동안 재발이 없었고 2명은 재발되었지만 면역관문억제제로 치료받은 후 반응을 보였다(5).
두번째 연구에서도 예측모델을 이용하여 10개의 개인 맞춤형 신항원을 RNA 프랫폼과 면역 자극제를 이용하여 13명의 환자에게 주입했다. 이들 중 9명의 환자는 재발이 12-23개월간 관찰되지 않았고 2명을 제외한 모든 환자들은 연구기간동안 생존했다. 흥미롭게도 1명의 환자는 종양이 진행되었지만 백신주사 후 면역관문억제제로 치료를 받고 완치 판정을 받았다(6).
세번째 연구에서는 이전에 다양한 치료를 받은 흑색종 환자들을 대상으로 종양 침투 림프구(Tumor infiltrating lymphocytes, TIL)를 세포 배양한 후 주입했다. 이들 중 약 20% 정도 환자들이 완치를 보였고 중요하게도 환자들에게 주입되었던 많은 TIL이 신항원을 실제로 인지하고 있음을 보여주었다(7).
2013년 이후 신항원을 이용한 73개의 임상시도가 진행되어 왔다. 이들 중 약 3분의1이 2018년 1/4분기에 시작되었다(그림 3). 또한 올해 시작된 신항원 임상 시도들 중 3분의1이 면역관문억제제와의 병용치료로 진행되고 있다는 점을 주목할 필요성이 있다.
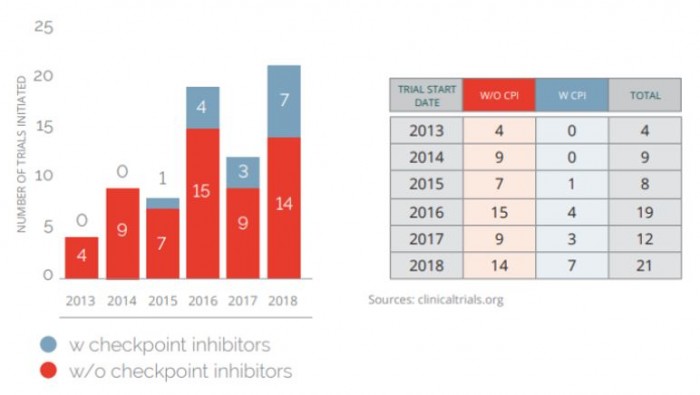
▲2013년에서 2018년까지 신항원 종양 백신을 이용한 임상시도의 증가
4) 대규모 투자들이 신항원 백신 개발 기업으로 몰리고 있는 현상은 차세대 I-O 약물로서 신항원 종양백신 개발을 가속화시키는 원동력이 되고 있음을 대변하고 있다.
현재 신항원 백신 개발을 하고 있는 바이오텍 회사들은 약 30개 이상인 것으로 알려져 있다. 이들 중 11개가 공개 상장되었으며 나머지는 민간자본으로 운영되는데 벤처캐피탈로부터 지난 2년 동안 투자된 금액이 $1.3 billion에 이른다(이 투자금은 $1.6 billion을 투자받은 Moderna를 제외한 금액이다). 이들 신항원 종양 백신 기업들은 형태와 접근방식에 따라 몇가지 유형으로 나뉠 수 있다(그림 4).
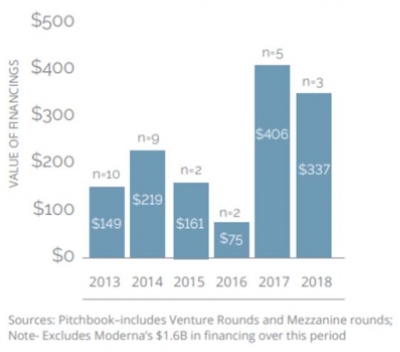
▲신항원 암백신 개발 회사에 대한 투자액 (2013년에서 2018년까지)
이들 중 주목할 만한 기업은 독일에 기반을 둔 BioNTech이다. 이 회사는 신항원을 발현하는 RNA 를 합성하여 환자에게 주입함으로 T세포를 자극하고 종양을 치료할 수 있는 방법들을 고안해냈다. BioNTech은 신항원을 예측하여 이를 개인 맞춤형 백신으로 사용함으로 암의 재발을 감소시킬 수 있음을 흑색종 환자를 대상으로 한 임상을 통해 보여주었다. 이러한 결과를 바탕으로 글로벌 기업인 Genentech과 파트너쉽을 맺었고 RNA를 기반으로 한, 신항원 종양 백신을 사용하는 임상개발이 본격화되고 있다(8).
또 다른 주목할만한 바이오텍 회사는 신속한 프로그램과 적절한 가격의 시퀀스 방법을 통해 빅테이터를 처리하고 AI 기술을 사용하고 있는 Neon Therapeutics와 Gritstone이다. Neon Therapeutics 창업자들은 흑색종 환자들에서 신항원 종양 백신의 효능을 임상적으로 입증한 Catherine Wu와 2018년 노벨 의학상 수상자인 Jim Allison이다. Neon Therapeutics는 개인 맞춤형의 신항원 펩타이드를 활용한 백신을 생산하는 기술뿐 아니라 T세포가 신항원을 인지하도록 엔지니어링하는 기술을 보유하고 있다. Neon Therapeutics는 벤처 캐피탈과 BMS 및 Merck와의 파트너쉽을 통해 $170 million 펀드를 확보해 둔 상태이다.
Gritstone은 Timothy Chan와 Naiyer Rizvi의 연구결과를 바탕으로 설립되었다. 이들의 연구 결과는 non-small cell lung cancer(NSCLC) 환자들에서 면역관문억제제의 효능과 tumor mutational burden 의 연관성을 밝혀냈고 종양 치료에서 신항원의 중요성을 제시했다. Gritstone은 AI 기술을 기반으로 신항원을 예측하는 프로그램 개발과 바이러스 벡터를 이용하여 신항원을 전달함으로써 T세포를 자극하는 종양 백신 개발을 위해 $200 million의 연구자금을 조성한 것으로 알려져 있다.
5) 신항원 종양 백신 개발은 초기 단계에 있기 때문에 한국 기업들에게 I-O 분야를 주도할 수 있는 기회가 될 수 있다.
신항원은 종양 백신 개발에서 상대적으로 후발주자이고 여전히 해결해야 할 중요한 문제들이 있다. 우선은 신항원 종양 백신이 임상에서 성공하기 위해 해결해야 할 이슈들은 무엇인가? 다른 immuno-oncology 약물들과 어떻게 병용할 것인가? 등의 문제이다. 이러한 문제들을 해결하기 위해서 다음과 같은 분야들을 고려할 필요성이 있다.
현재 개발되고 있는 대부분의 백신은 CD8+ T세포를 자극할 것으로 예측되는 신항원에 집중되어 있다. 그러나 CD8+ T세포는 종양을 직접적으로 제거하지만 CD4+ 세포의 도움이 있어야 이러한 역할을 효율적으로 수행할 수 있다. 그러나 CD4+ T세포를 자극할 수 있는 신항원을 예측하는 모델은 상대적으로 그 개발이 빈약한 실정이다. 또한 현재 개발되고 있는 신항원의 소스가 종양 세포의 DNA 돌연변이에만 의존하고 있는데 효과적인 신항원은 미토콘드리아 DNA 에서도 그 개발이 가능하다는 점을 주목할 필요성이 있다(9).
신항원 백신과 IO 약물과의 병합치료는 난소암, 유방암, 두부경부암과 췌장암과 같이 면역관문억제제에 대한 반응이 낮거나 중간정도인 암들에 대한 치료 효능을 개선할 수 있을 것으로 기대된다. 특히 신항원 암 백신과의 병용치료는 다른 병용치료와는 달리 면역 독성은 낮을 것으로 예상된다. 예를들어 regulatory T cells과 macrophages/myeloid-derived suppressor cells 같은 면역 억제세포들의 수나 기능을 낮추는 약물들과 신항원 종양 백신과의 병용치료는 효능은 높이지만 독성은 상대적으로 낮출 수 있을 것으로 기대된다.
국내 몇몇 바이오텍 기업들은 뛰어난 DNA/RNA 시퀀싱 기술을 보유하고 있고 병원들의 임상 경험과 서비스는 우수한 것으로 평가되고 있다. DNA/RNA 시퀀싱 기술은 IT와의 접목을 통해 신항원을 정확히 예상할 수 있는 AI 개발로 이어질 수 있는 토대가될 수 있을 것이다. 병원의 우수한 인력과 임상 경험은 암환자의 면역 시스템을 분석하고 신항원 종양 백신을 선별하여 환자를 치료하는 시스템을 구축하는데 유용할 것이다. 따라서 성공적인 신항원 종양 백신 개발을 위해서 국내 바이오텍 기업과 병원및 학계가 보유하고 있는 경험, 기술과 자원을 연결하여 효율적으로 운영되는 시스템을 구축하는 일이 우선적으로 선행될 필요성이 있다.
맺는 말
최근 투자가들과 대형 제약사들은 신항원 종양 백신 개발과 예측모델 개발을 위해 대규모 투자를 하고 있다. 그러나 효과적인 신항원 종양 백신이 임상에서 성공하기 위해서는 다음과 같은 해결해야 할 몇가지 핵심적인 사안들이 존재한다.
임상 샘플의 획득, NGS 기술을 통한 mutation의 동정, 정확한 신항원의 예측이 가능한 AI 개발, 신항원 선별을 위한 면역학적인 에세이 방법의 개발, 신항원의 효능을 극대화시킬 수 있는 면역 자극 보조제의 선택, 이러한 과정에서 환자를 치료하기 위해 소요되는 시간과 비용의 문제, 효과적인 병용치료를 위한 면역관문억제제나 I-O 약물들의 선택 기준들이 그 예가 될 수 있다. 또한 서로 다른 이득이 맞물려 있는 병원, 학계, 기업가와 투자가들을 포함하는 네트워크의 합리적인 구성과 운영도 성공적인 신항원 종양 백신을 개발을 위해 해결해야 할 문제로 인식된다.
기존의 I-O 약물들을 포함하는 항암제들이 ‘off-the-shelf’ 기반의 약물이라면 신항원 종양 백신은 잘 구축된 시스템을 통해 가능한 ‘system selling’의 기반을 둔 약물이 될 것이다. 즉, 신항원 종양 백신 개발이 성공적으로 진행되기 위해서는 주어진 시간에 효과적인 신항원을 제조하여 환자에게 전달하는 시스템에 의존하게 될 것으로 전망된다. 따라서 이러한 시스템은 다양한 분야들을 통합시키는 매우 기술집약적인 성격을 갖고 있기 때문에 이로 인한 경제적인 파급 효과는 클 것으로 예상된다. 즉, 신항원 종양 백신을 개발하기 위해서는 다양한 기술들과 조직들의 네트워크가 필요하고 이러한 통합적인 운영체계는 결국 파이의 사이즈를 키워 그 혜택을 참여하는 구릅에 분배하는데 기여할 수 있을 것이다. 따라서 신항원 종양 백신의 이러한 기술집약적인 특성은 다양한 관련산업을 발전시키는 원동력과 영향력을 갖고 있는다는 점을 이해할 필요성이 있다.
여러가지 도전적인 문제들에도 불구하고 신항원 종양 백신 개발은 지난 20여년간 언급되어 온 개인 맞춤형 약물의 구체적인 성과물이 될 것으로 기대되고 있다. 따라서 이러한 도전적인 문제들을 극복할 때 성공적인 신항원 백신 개발은 암과 싸우고 있는 환자들, 임상의, 연구자들과 바이오 기업들을 포함하는 모두에게 새로운 희망을 줄 수 있는 차세대 면역항암제가 될 것으로 기대된다.
References:
1. C.A. Klebanoff, “Shared cancer neoantigens: Making private matters public,” Journal of Experimental Medicine, 215(1), January 2, 2018: 5-7.
2. “The Problem With Neoantigen Prediction” (editorial), Nature Biotechnology 35(2), February 8, 2017: 97.
3. N.A. Rizvi et al., “Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer,” Science 348(6230), April 3, 2015: 124-8.
4. L.B. Alexandrov et al., “Signatures of mutational processes in human cancer,” Nature, 500(7463), Aug 22, 2013: 415-21.
5. P. Ott et al., “An immunogenic personal neoantigen vaccine for patients with melanoma,” Nature 547(7662), July 13, 2017: 217-221.
6. U. Sahin et al., “Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer,” Nature 547(7662), July 13, 2017: 222-226.
7. S.A. Rosenberg et al., “Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy,” Clinical Cancer Research 17(3), July 1, 2011: 4550-7.
8. N.P. Taylor, “GenenTech lays $310M wager on BioNTech’s mRNA cancer vaccine platform,” Fierce BioTech, September 21, 2016.
9. R.F. Wang et al., “Immune targets and neoantigens for cancer immunotherapy and precision medicine,” Cell Research 27(1) January 27, 2017: 11-37.


















