오피니언
아마린, '임상성공→시판→특허패소'..시사점은?
바이오스펙테이터 서일 기자
아마린의 오메가-3 지방산 유래 의약품 '바세파' 美특허권 2심 패소...아마린 "유럽, 중국 등 다른 시장 집중"
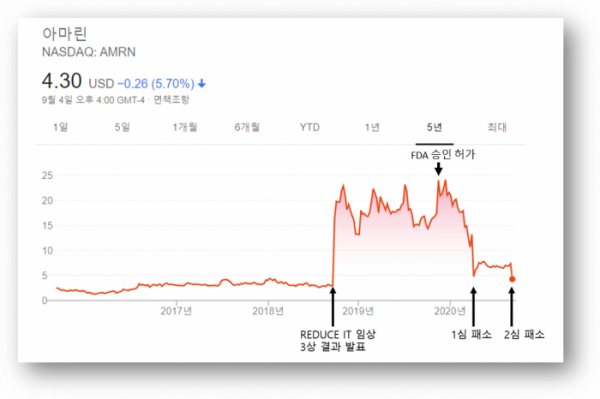
▲구글 아마린 주가 검색 이미지 기반으로 바이오스펙테이터 재구성
아마린(Amarin)의 '바세파(Vascepa)'는 우수한 임상 결과를 기반으로 시장을 확대하면서 업계의 주목받았지만, 최근 특허 재판에서 패소하면서 화제의 중심이 되고 있다. 좋은 임상결과로 각광받던 약물도 특허권 논란을 이겨내지 못한다면 제네릭 약물과 경쟁해야 하는 상황에 내몰릴 수밖에 없다는 것을 보여주는 케이스다.
아마린(Amarin)의 '바세파(Vascepa, Icosapent ethyl)'는 고중성지방혈증(hypertriglyceridemia) 환자의 중성지방을 낮추는 저해제로 2012년 FDA승인을 받았다. 바세파는 고순도로 정제된 오메가-3 지방산으로 96% 이상의 EPA(Icosapent ethyl)로 이루어져 있다. MARINE임상 3상 결과 바세파는 LDL(Low Density Lipoprotein)을 높이지 않으면서 중성지방(triglyceride, TG) 수치를 낮췄다. 기존 오메가-3 지방산 기반 약물인 '로바자(Lovaza)'가 LDL을 높이는 부작용을 해결했다.
이어 아마린은 더 넓은 환자군으로 바세파의 적응증 확대를 시도했다. 아마린은 심혈관계 질환(Cardio Vascular, CV) 환자를 대상으로 2012년부터 7년에 걸쳐 바세파의 REDUCE-IT 임상3상을 수행했다. 심혈관계 질환은 미국의 사망원인 1위이며, 심혈관계 질환 환자들은 보통 스타틴(Statin)치료를 받는다. REDUCE-IT임상 3상은 스타틴 치료를 받고 있는 고지혈증 환자 8179명을 대상으로 했다.
임상 결과는 긍정적이었다. 2018년 아마린의 발표에 따르면 바세파를 처방받은 그룹은 위약(placebo)그룹에 비해 주요 심혈관 사건(Major Adverse Cardiovascular Event, MACE) 발생률이 약 25% 낮았다. 이에 따라 주요심혈관계 질환과 심장마비, 뇌졸중 등의 치료제로 바세파의 확장성에 대한 기대감이 높아졌다. 이 소식에 당일 아마린 주가는 300% 이상 급등했다.... <계속>



















