기업
뇌경색後 신경세포 사멸 막는 '다기능 합성화합물' 개발
바이오스펙테이터 조정민 기자
[쿠바 바이오파마 기술소개③] 허혈 후 재관류로 인한 신경세포 손상 방지하는 합성화합물 개발
허혈성뇌경색(Ischemic stroke)은 전세계 사망 요인 중 3위에 해당하는 질환이며 영구적인 기능장애의 주요 원인 중 하나다. 미국의 경우 2015년 한 해에만 허혈성 뇌경색과 관련해 1830억 달러의 비용을 지출한 것으로 나타났다.
현재 뇌경색 이후 치료를 위한 선택지는 혈전의 섬유소를 분해하는 단백질 가수분해효소를 활성화하는 재조합 조직 플라스미노겐 활성인자(recombinant tissue plasminogen activator)를 적용, 혈관을 막고 있는 혈전을 제거하는 방법이 있다.
하지만 이 방법은 체내 출혈 사인 또는 출혈 이력이 있으면 사용이 금지되는 등 치료범위가 적고 제약이 많아 약 10%의 환자에게만 적용이 가능하다. 또한 허혈 이후 발생하는 신경세포의 손상과 사멸을 막을 수 없기 때문에 장기적 또는 영구적인 뇌기능 장애를 남기기도 한다.
혈전 등의 이유로 혈관이 막혀 혈류가 차단되면 뇌에서 사용하는 산소와 당의 공급이 부족해진다. 에너지원의 상실은 생체 에너지의 손실로 이어지고, 에너지를 통해 유지되던 세포막 전위가 변해 칼슘의 세포 내 유입이 급격히 증가한다. 내부의 칼슘농도가 높아진 신경세포는 흥분성 신호전달물질인 글루타메이트(glutamate)를 방출해 인접 세포의 세포막에 존재하는 NMDA수용체를 활성화함으로써 칼슘 유입을 증가시키는데 이러한 칼슘의 과적은 세포 사멸의 원인이 된다.
또한 막혔던 혈관에서 재관류가 일어날 때 발생하는 활성산소도 문제 요인으로 작용한다. 갑자기 많은 산소와 접하게 된 세포는 조절 가능한 범위를 초과하는 활성산소를 생성하게 되고 발생한 활성산소가 가진 반응독성으로 인해 2차적인 세포사가 이뤄지는 것이다
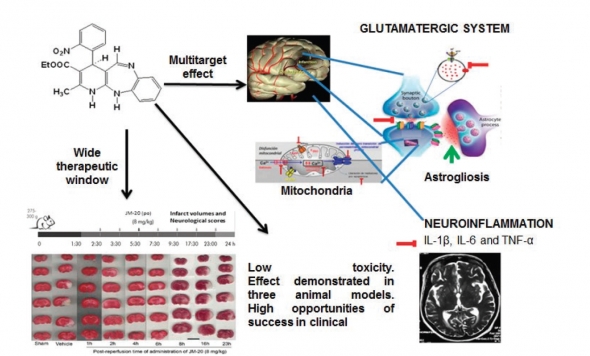
▲CIDEM-161의 작용기전 모식도. (제공: Cuba bioparma)
쿠바 의약품 연구개발센터(Centro de Investigacion y Desarrollo de Medicamentos; CIDEM) 연구진은 허혈성 뇌경색 발생 이후 신경세포 보호와 기능 보전을 목표로 1,5-벤조디아제핀(1,5-Benzodiazepine)과 디하이드로피리딘(Dihydropyridine)을 결합한 합성화합물 CIDEM-161을 개발했다. 이들은 전임상 단계의 동물실험을 통해 항산화효과, 칼슘유입 방지와 더불어 세포사멸과 염증반응을 억제하는 효과를 확인했다고 밝혔다.
최근 국제 학술지에 발표한 수 편의 논문을 살펴보면, CIDEM-161은 일시적인 허혈 유도 마우스 모델의 뇌척수액에서 글루타메이트의 농도를 낮추는 효과를 보였으며, 신경세포 간 신호전달이 이뤄지는 세포 말단의 시냅스에서 글루타메이트가 분비되는 것 역시 감소시켰다.
또한 중추신경계에 존재하는 성상세포와 신경세포를 동시에 배양하는 세포 실험을 통해 허혈성 스트레스 이후 CIDEM-161을 처리하면 성상세포의 글루타메이트 흡수가 증가하는 것을 관찰했다. 이는 신경세포에 전달되는 글루타메이트의 양이 상대적으로 감소하면서 NMDA 수용체 활성화를 둔화하고 칼슘 유입을 막아주는 기전으로 작용한다.
그 밖에도 변형된 신경세포를 제거하는 기능의 미세아교세포 활성화를 억제하고 염증과 면역반응에 관여하는 인터루킨-1 베타(IL-1β)와 인터루킨-6(IL-6)의 발현 감소 효과와 세포 사멸을 유도하는 Caspase-3 활성화를 저해하는 결과까지 확인할 수 있었다.
현재 세포실험과 동물실험을 통한 CIDEM-161의 전임상은 모두 완료된 상태이며, 유전물질손상(Genotoxicity) 여부 확인과 물리-화학적 특성화에 대한 실험을 진행하고 있다. 연구진은 물질의 제형 연구와 더불어 아만성 독성 확인을 위한 실험을 계획 중이다.
쿠바의 바이오산업을 총괄하는 쿠바바이오파르마는 오는 9월 12일 서울 양재동 엘타워에서 열리는 ‘한-쿠바 바이오파마 기술교류 세미나’에서 CIDEM-161을 공동 개발하고 임상을 진행할 파트너를 찾기를 원한다고 밝혔다.

















