국제
세포 청소부 '오토파지' 퇴행성 뇌질환 새 돌파구 될까
바이오스펙테이터 장종원 기자
브라운대 연구진, ALS 모델서 오토파지 활성 조절 성공..항암제 닐로티닙→파킨슨병 치료제 2상 돌입..뉴로포어, 카스마, 유영제약 등도 치료제 개발 도전
세포 내 청소부. 세포에서 필요없거나 손상된 물질·기관을 분해해 다시 에너지원으로 재생산하는 현상인 자가포식 다른말로 오토파지(Autophagy)를 일컫는 말이다. 2016년 일본 오스미 요시노리 교수를 노벨 생리의학상으로 이끈 오토파지가 신약개발 현장에서도 주목받기 시작했다. 특히 오토파지와 파킨슨병 등 퇴행성 뇌질환과의 연관성을 밝히는 연구결과들이 속속 발표되며 난치성 질환 극복을 위한 새로운 길을 열고 있다.
우리 몸의 세포는 끊임없는 오토파지를 통해 새로운 에너지를 공급받고 노화에 대응한다. 오토파지의 과정은 이렇다. 세포 안에서 손상되거나 필요없어진 대사물질 또는 세포 소기관이 나타나면 이를 세포막으로 감싸는 자가소포체(Autphagosome)가 생성된다. 이 자가소포체는 세포내 소기관인 리소좀(Lysosome)으로 이동해 결합하게 되고 리소좀이 가진 분해효소가 자가소포체 안의 물질을 분해한다. 분해가 끝난 분자와 대사물질은 에너지원으로 재활용된다.
이런 오토파지 현상이 잘 작동하지 않으면 어떻게 될까? 변형된 단백질과 소기관들이 쌓여 세포의 항상성을 무너뜨린다. 알츠하이머, 파킨슨병과 같이 병리적 단백질의 축적으로 발생되는 퇴행성 뇌질환에서 새로운 치료제의 타깃으로 오토파지가 주목받는 이유다. 오토파지는 단백질 변이, 노화 등으로 인한 암, 퇴행성 질환 등을 치료하는데 중요한 키 플레이어로 작용할 것으로 기대되고 있다.
◇브라운대 연구팀, ALS 모델서 오토파지 활성 조절
미국 브라운대 연구팀은 지난 15일 국제학술지 '셀 리포트(Cell Reports)'에 게재한 논문에서 오토파지를 자극함으로써 알츠하이머, 근위축성축삭경화증(ALS)과 같은 퇴행성 신경계 질환을 치료할 수 있는 가능성을 엿봤다. 오토파지에 관여하는 전사인자(Transcription factor) HLH-30/TFEB의 세포 내 위치에 따라서 오토파지 활성을 조절할 수 있다는 것이 연구의 핵심이다.
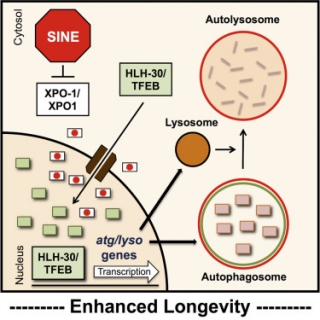
▲Nuclear export inhibition enhances HLH-30/TFEB activity, autophagy, and lifespan. Cell Reports.
연구팀은 오토파지를 활성화하기 위해 이를 조절하는 전사인자가 핵 내에 오래 머물도록 조절해야 한다고 가정, 전사인자의 이동에 관여하는 유전자를 찾기 위한 스크리닝을 진행했다. 그 결과 XPO1가 핵 내의 물질을 바깥으로 이동시키는 역할을 하는 수송 단백질이라는 것을 확인했다. 선충을 이용한 실험에서 XPO1 단백질을 감소시키자, 오토파지 전사인자인 TFEB가 핵 내에 축적됐으며 자가포식소체(Autophagosome)와 리소좀이 증가하는 결과를 얻었다.
연구팀은 다음으로 암 치료에서 XPO1을 억제하기 위해 사용된 SINE(Selective Inhibitor of Nuclear Export, 핵 내 물질의 송출을 선택적으로 억제하는 약물)이 XPO1 유전자를 억제한 것과 동일한 효과를 나타내는 것을 선충 모델에서 확인했다.
연구팀은 이러한 연구결과가 퇴행성 뇌질환 치료에 적용 가능한지 확인하기 위해 ALS를 유전적으로 유발한 초파리 모델에서 SINE을 처리하고 예후를 관찰했다. 그 결과, 질병동물모델의 수명이 연장되는 결과를 얻었다. 또한 인간의 자궁경부암의 조직에서 얻어낸 세포주인 헬라세포(Hela cell)에 SINE을 적용했을 때, 핵 내의 TFEB 농도가 증가했으며 오토파지 활성을 보여주는 마커들 역시 증가하는 것을 관찰했다.
라피에르(Lapierre) 박사는 "선충에서 사람에 이르기까지 TFEB의 세포 내 위치조절이 오토파지 활동을 조절할 수 있으며, 암 치료에 사용되는 SINE이 중추신경계에서도 오토파지를 자극함으로써 퇴행성 뇌질환의 새로운 치료제로 사용될 수 있는 가능성을 확인했다"고 말했다.
◇항암제 닐로티닙으로 파킨슨병 조준.. 임상2상 돌입
앞선 2015년 미국 조지타운대학 연구팀이 진행한 작은 임상연구 결과는 파킨슨병 분야에서 흥미를 불러일으켰다. 노바티스가 개발한 항암제 닐로티닙(Nilotinib)이 파킨슨병과 루이소체(Lewy body)로 인한 치매에 효과가 있다는 연구결과였다. 연구팀은 12명의 중말기 파킨슨질환자를 대상으로 24주간 닐로티닙을 적용하고, 치료 이후 12주까지 관찰했다.
닐로티닙은 타이로신 인산화효소 억제 기전의 저분자화합물(Tyrosine kinase inhibitor)로 이마티닙(imatinib)에 내성이 발생한 만성골수성백혈병(Chronic myeloid leukemia)을 적응증으로 허가 받은 항암제다. 이 약물은 종양 성장에 역할을 하는 Bcr-abl 결합 단백질의 인산화를 차단해 암세포가 증식하는 것을 막는다.

그런데 세포 내의 abl단백질이 오토파지에 관여하는 'Parkin 단백질'과 결합하면 그 기능을 방해한다는 연구결과가 발표됐다. 파킨슨병을 유도하는 약물인 'MPTP'를 처리한 세포에서 abl단백질을 차단했더니 오토파지를 통해 신경독소(neurotoxin)가 줄어드는 것을 확인한 것이다. 이 외에도 abl단백질이 알파-시누클레인(Alpha-Synuclein)의 축적에 관여한다는 것 등이 밝혀지면서 abl단백질 활성을 막는 닐로티닙이 새로운 파킨슨병 치료제로서의 가능성을 보였다.
가장 중요한 포인트는 항암제인 닐로티닙의 뇌-혈관장벽(BBB) 통과 여부였다. 앞의 조지타운대학 연구팀은 여러 번의 실험을 통해 닐로티닙이 적용 후 2시간이 지나자 뇌에서 최고 농도를 보이는 것을 확인했고 뇌에서의 타깃(abl)단백질의 농도가 적용 1시간 후 30% 감소하는 것과 몇 시간동안 활성이 안정적으로 유지되는 것을 확인했다.
또한 24주 이후 파킨슨병의 주요 증상인 운동장애를 측정하는 UPDRS(unified parkinson;s disease rating scale)점수가 평균 3.6점 이상 감소하는 것을 확인할 수 있었다. UPDRS 점수가 줄어드는 것은 파킨슨병의 운동장애 증상이 호전된 것을 뜻한다.
이러한 결과를 바탕으로 2017년 9월, 미국 노스웨스턴대학 의대 연구팀은 파킨슨병을 적응증으로 하는 닐로티닙 임상2상을 시작했다. 이번 임상은 중기 이상의 파킨슨병 환자에게 위약과 닐로티닙(150mg, 300mg)을 적용하고 증상 호전과 병기진행에 관한 효과를 확인한다.
◇뉴로포어, 카스마, 유영제약 메디헬프라인 등 오토파지 기전 치료제 개발 나서
미 샌디에이고에 위치한 뉴로포어 테라피(Neuropore Therapies)는 2008년에 세워진 바이오텍으로 파킨슨병과 알츠하이머 등 퇴행성 뇌질환 치료제를 개발하고 있다. 이들은 ①병리적 단백질의 생성을 억제 ②세포의 자연적인 메커니즘을 통해 독성 단백질을 제거하고 세포 기능 회복 두 가지 전략을 가지고 치료제를 개발하는데 여기서 말하는 독성 단백질을 제거하는 세포의 메커니즘이 바로 오토파지다.
뉴로포어는 거대과오단백질(large misfolded protein)을 제거하는 오토파지 기전을 활성화하는 후보물질들을 세포실험과 동물실험을 통해 발굴, 확인하고 있으며 그 중 파킨슨병의 알파-시누클레인을 제거하는 NPT200-11의 임상 1상을 2016년 마쳤다.
이달 3일에는 오토파지를 이용해 치료제를 개발하는 미국 바이오벤처 카스마 테라퓨틱스(Casma therapeutics)가 5800만달러 규모의 시리즈A 투자를 받았다. 이 회사 CEO인 Keith Dionne는 "퇴행성 뇌질환에서 오토파지 활동이 줄어들어 역할을 잃은 물질들이 제때 제거되지 못함으로써 세포의 기능이 퇴화하고 세포가 사멸하기 시작한다. 우리는 오토파지 세포가 건강한 상태를 유지할 수 있도록 하는 신개념 물질을 개발할 것"이라고 말했다. 이들은 퇴행성 뇌질환 뿐만 아니라 간과 근육 등에서 발생하는 질환 치료제도 개발할 것이라고 밝혔다.
국내에서는 메디헬프라인과 유영제약이 오토파지 관련 신약개발을 하고 있다. 메디헬프라인은 파킨슨신약 후보물질 'WIN-1001X'의 임상 2상 진행할 계획이다. WIN-1001X는 오토파지(Autophagy) 활성 유도 및 신경세포사멸(Apoptosis) 억제 기전의 항파킨슨 후보물질로 알려져 있다. WIN-1001X는 최근 보건의료 기술연구 개발사업 과제에도 선정돼 정부로부터 임상 2상 비용으로 33억원을 지원받게 됐다. 유영제약은 2016년말 자회사인 ‘오토파지사이언스’를 설립했다. 오토파지 현상을 이용해 비알콜성 간질환(NASH)를 시작으로 섬유화(fibrosis), 퇴행성뇌질환 등의 치료제를 개발한다는 계획이다.



















