피플
"HSPA9 기능저하→퍼록시좀 감소→파킨슨병 발병"
바이오스펙테이터 장종원 기자
경북대·생명연, 파킨슨병 신타깃 규명 연구 'Autophagy'에 게재.."세포소기관의 통합적 기능관리가 신경퇴행성 질환 치료에 중요"
국내 연구진이 유전자 단백질 'HSPA9'이 돌연변이로 기능이 저하되면 에너지대사 및 활성산조 조절 주요 세포소기관(퍼록시좀)의 현저한 감소를 유도해 파킨슨병의 원인이 될 수 있음을 규명했다. 현재까지 미토콘드리아 기능 이상이 주된 원인으로 알려진 파킨슨병 연구 분야에 퍼록시좀의 중요성을 새롭게 제시한 연구결과다.
경북대 생명과학부의 조동형 교수(교신저자), 조두신 박사(제1 저자)와 한국생명공학연구원 바이오나노연구센터의 이규선 센터장(공동 교신저자)은 인간 HSPA9 유전자에 의해 암호화되는 미토콘드리아에 존재하는 단백질인 'HSPA9'와 파킨슨병과의 관계를 규명한 연구가 최근 Autophagy(IF 11.1) 온라인 판에 게재됐다고 19일 밝혔다(논문명 : Loss of HSPA9 induces peroxisomal degradation by increasing pexophagy).
세포내 존재하는 퍼록시좀(peroxisome)은 단일막 구조의 세포소기관으로 대부분의 진핵 세포에 존재하며, 소포체로부터 생성돼 주로 지방산의 산화반응이 일어나는 장소로 지방산 분해와 콜레스테롤 대사를 조절하는 기능을 한다. 포유류에서는 뇌, 간, 심장 및 폐 조직의 에너지 대사에 중요한 역할을 한다. 특히, 유전적으로 퍼록시좀 생성과 분해에 문제가 생기면 젤웨거 증후군(Zellweger syndrome)과 같은 선천성 뇌신경계 발달장애로 이어진다.
또한 간세포에서 퍼록시좀은 과산화수소를 물로 전환시켜주는 효소(카탈레이즈; Catalase)를 다량 보유하고 있어, 알코올 등과 같은 독성물질을 제거하거나, 노화의 원인이 되는 세포내 유해산소를 제거하는 중요한 기능을 수행한다. 따라서, 선천성 유전자 변이나 노화에 따른 퍼록시좀의 기능이상의 원인 규명, 손상된 퍼록시좀의 회복에 관련된 연구가 선천성 뇌신경계 발달장애 및 파킨슨병과 같은 신경퇴행성질환 분야에서 새로운 치료전략의 타겟으로 주목받고 있다.
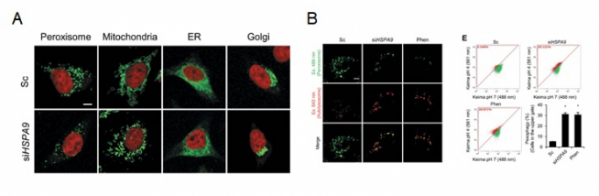
연구팀은 HSPA9 유전자 변이가 산화스트레스의 증가와 세포소기관인 퍼록시좀 감소로 이어져 신경세포 또는 근육 세포의 기능 저하를 통해 파킨슨병 발병의 원인이 될 수 있음을 확인했다. 또한 세포소기관인 퍼록시좀 특이적인 자가포식작용(autophagy) 조절을 통해 퍼록시좀 감소가 일어나는 것을 규명했다.
연구팀은 RNA 간섭법을 이용해 세포 또는 초파리 동물모델에서 HSPA9/Hsc70-5 유전자의 발현을 감소시킨 경우에, 퍼록시좀의 현저한 감소가 나타나며 자가포식작용에 중요한 ATG5 또는 ATG7 유전자가 결핍될 경우, 이러한 현상이 회복되는 것을 확인해 HSPA9 유전자 변이에 의한 퍼록시좀 감소가 자가포식작용에 의한 것을 규명했다.
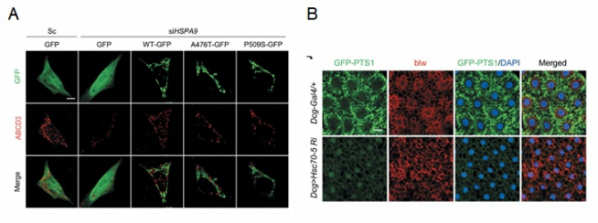
동일 조건에서 정상 HSPA9 유전자를 다시 도입할 경우에는 퍼록시좀 감소가 회복되는 반면, 파킨슨병에서 보고된 돌연변이 유전자를 도입할 경우에는 퍼록시좀 감소가 회복되지 않는 것을 확인해 파킨슨병 병인기전에 퍼록시좀 기능이상이 연관돼 있음을 제시했다. 연구팀은 "세포소기관의 통합적인 기능관리가 신경퇴행성질환을 포함한 노인성 질환 치료에 있어 중요함을 입증했다는데 의의가 크다"고 설명했다.
이규선 한국생명공학연구원 센터장은 “퍼록시좀과 미토콘드리아와 같은 세포소기관의 상호작용과 퍼록시좀 기능 유지에 연관된 다양한 조절 인자들을 동시에 표적으로 하는 신약 개발은 신경퇴행성질환을 비롯한 암, 대사질환 및 노인성 관련 질환 등의 치료제 개발에도 폭넓게 활용될 수 있을 것으로 기대된다”고 밝혔다.



















