기업
신라젠, AACR 2020서 '펙사벡+PD-1 병용' 1상 발표
바이오스펙테이터 김성민 기자
진행성 신장암 환자 대상 펙사벡과 리제네론 PD-1 면역관문억제제 '세미플리맙' 병용투여..ORR 37.5%, DCR 75%

신라젠은 진행성 신장암(advanced RCC) 환자에게 항암바이러스 펙사벡(JX-594)과 리제네론의 PD-1 면역관문억제제 '세미플리맙(제품명: 리브타요, REGN2810)'를 병용투여한 임상1b상의 중간 분석 결과를 미국암연구학회(AACR) 온라인 발표를 통해 27일(현지시간) 공개했다. 펙사벡은 면역을 활성화하는 GM-CSF를 탑재한 백시니아 바이러스다.
이번 AACR에서 발표한 결과는 용량증량 및 확장 코호트C에 참여한 환자 데이터다. 이전에 면역관문억제제 치료 경험이 없거나(naïve) 전신투여 약물 치료후 재발한 진행성 신장암 환자에게 펙사벡 3x10^8 또는 1x10^9 pfu 용량을 매주 4회 정맥투여했으며, 이와 함께 세미플리맙 350mg을 병용투여했다(NCT03294083).
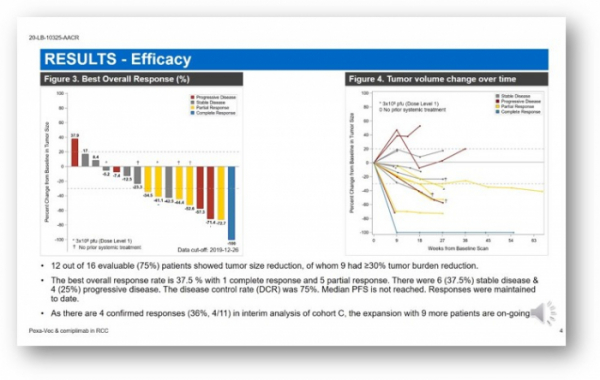
유효성 결과가 분석 가능한 정맥투여 환자군 16명 중에서 종양이 완전히 사라지는 완전반응(CR) 1명, 부분반응(PR) 5명, 안전병변(SD) 6명, 병기진행(PD) 4명을 관찰했다. 결과적으로 전체 반응률(ORR)은 37.5%, 질병통제율(DCR)은 75% 였다. 무진행 생존기간(PFS)의 중간값에는 아직 도달하지 않아 평가 중이다.
약물 안전성도 확인했다. 3등급 이상의 부작용은 5.7% 발생했으며, 주로 감기 증상, 약물투여 직후 일시적 혈압 상승, 일시적인 폐렴(pneumonia) 증상 등이 보고됐다. 또한 면역관련 부작용(irAE)은 없었다.
발표를 진행한 라선영 연세대 교수는 이번 결과에 대해 "진행성 신장암 환자를 대상으로 한 이번 REN026 스터디에서 펙사벡 정맥투여와 세미플리맙 병용투여에 따라 안전성 프로파일과 임상적 효능 가능성을 확인했다"며 "현재 펙사벡과 세미플리맙 확장 코호트C와 새롭게 추가한 이전에 면역문억제제를 투여받고 다시 병기진행되는 코호트D 평가를 진행중이다"고 설명했다.
한편 신라젠은 지난해 열린 AACR 2019에서 비임상 동물 모델에서 펙사벡을 정맥투여하자 종양혈관(tumor vasculature)에 일차적으로 감염된 다음 주위 암세포로 퍼져나가는 항암 메커니즘과 면역관문억제제와 병용투여에 따른 시너지 효과를 발표한 바 있다.
▲AACR 2020 온라인 발표 자료.



















