탐방
파멥신 "타니비루맵, 고형암 블록버스터 아바스틴 뛰어넘을것"
바이오스펙테이터 김성민 기자
유진산 대표 "내년 중반께 호주 2a임상 마무리, 기술이전 통해 코스닥 재상장 추진"

▲유진산 파멥신 대표
파멥신은 태생부터가 남달랐다. 하지만 그만큼 고단한 길이 예정돼 있었는지도 모른다. 2008년 설립당시부터 파멥신은 글로벌 신약의 큰 기대를 갖고 글로벌 플레이어들의 관심속에서 사업을 시작했다. 글로벌 바이오 벤처투자사인 오비메드와 다국적 제약회사 노바티스가 글로벌 금융위기 상황속에서도 파멥신에 투자했다. 특히 노바티스는 2차례에 걸쳐 투자를 단행했는데 이는 국내 바이오벤처 중 유일한 사례다.
이는 파멥신이 개발하고 있던 완전인간 항체신약인 '타니비루맵(Tanibirumab)'이 있었기에 가능한 일이었다. 타니비루맵은 '차세대 아바스틴'으로 불릴 정도로 기대가 컸다. 하지만 말기 고형암 환자를 대상으로 한 국내 임상1상에서 발생한 ‘가역성 피부모세혈관종'은 신약개발의 어려움을 단적으로 보여준 사례중 하나가 되었다. 이는 신약의 안전성 측면에서 볼 때 부작용 보다는 발생빈도가 높았다는 점에서 부정적인 영향을 미쳤다.
하지만 무엇보다 아쉬운 것은 가역성 피부모세혈관종의 임상적 의미가 여전히 확인되지 않았음에도 불구하고 타니비루맵의 향후 개발에 불확실성이 존재한다는 이유로, 코스닥상장 심사과정에서 상장 미승인 결론을 내리도록 영향을 미쳤다는 점이다.
어쨌든 국내 임상2상 진입실패 이후, 파멥신은 임상 진행을 위한 새로운 길을 찾아야 했고 호주로 시선을 돌렸다. 이것이 가능했던 이유는 타니비루맵이라는 핵심 제품의 가치가 훼손된 것은 아니었기 때문이다. 파멥신은 올해 초 호주에서 재발성 악성교모세포종으로 타니비루맵(TTAC-0001) 임상 2a상에 들어갔다. 범부처신약개발사업단 과제로도 선정돼 임상에 필요한 연구비도 일부 지원받았다.
유진산 파멥신 대표는 최근 대전 유성구 소재 본사에서 진행된 바이오스펙테이터와의 인터뷰에서 "호주에서 임상을 하는 이유는 환자군(인종)이 다양해 향후 글로벌 임상 진출을 용이하게 할 뿐만 아니라 추후에 있을 기술이전을 고려한 결정이기도 하다"면서 "무엇보다 현재 재발성 악성교모세포종 치료제가 없는 상황에서 의료진들이 환자를 살리기 위한 새로운 치료제에 가장 절박했다"고 말했다.
파멥신은 내년 중반에 임상 2a상을 마무리한 후 임상 2b상은 미국, 유럽, 일본을 포함한 글로벌 임상을 진행할 계획이다. 유 대표는 "현재 우수한 효능을 확인한 삼중음성 유방암에서도 미국 임상 2상 진행을 위해 자금 확보하고 있는 중"이라면서 "향후 의료적 미충족 수요가 큰 적응증에 대하여 치료제 개발을 확대할 예정”이라 밝혔다.
코스닥 상장 역시 포기하지 않았다. 타니비루맵의 기술이전 속도를 앞당겨 그 성과로 코스닥 상장에 재도전한다는 계획이다.
◇타니비루맵, 같은 듯 다른 신생혈관 억제제
파멥신이 현재 가장 주력하고 있는 신약후보물질은 ‘차세대 아바스틴’이라는 별명을 가진 타니비루맵이다. 타니비루맵은 국내 최초로 개발을 시작한 완전인간항체로 기존의 카이메릭 항체나 인간화항체와 비교해 항체 자체가 체내 면역반응을 일으키는 ‘면역원성’이 크게 개선된 장점이 있다. 그렇다면 타니비루맵은 무엇을 타깃으로 하는 항암제일까?
암세포가 성장∙전이하는 과정을 보면 처음에는 작은 단위에 지나지 않았던 암세포는 특유의 무한증식 능력으로 자신을 지지해주는 다양한 세포들과 함께 세력을 키워 나간다. 그러다 암 덩어리가 1m㎥이상 자라게 되는데, 이때 외부로부터 산소와 영양분 공급이 급속도로 필요해져 암미세환경은 곧 저산소 상태에 빠지게 된다. 이에 종양미세환경은 동시다발적으로 주변 혈관에 신생혈관형성 인자를 폭발적으로 분비해 저산소 문제를 해결하려고 한다. 신생혈관형성 인자에 뒤덮인 암덩어리는 덩치를 늘려가고 또 향후 이 암신생혈관을 통해 다른 곳으로 세력을 확장하는 ‘전이’를 꿈꾼다.
이러한 역할을 하는 핵심 매개체가 ‘VEGF(Vascular endothelial growth factor, 혈관내피 성장인자)’로 원래는 발생초기, 상처가 생겼을 때 발현한다. 암세포가 분비하는 VEGF는 혈관 내피세포 표면에 존재하는 수용체 ‘KDR(혹은 VEGFR-2)’에 붙어 혈관성장을 촉진한다.
타니비루맵은 KDR을 타깃으로 하는 항체(anti-KDR antibody)로 VEGF가 KDR에 결합하지 못하게 한다. 이를 통해 신생혈관형성을 억제해 암세포 증식과 전이를 막는 것이다.
그런데 타니비루맵 역할은 여기서 멈추지 않는다. 타니비루맵은 IgG1에 속하는 항체로 몸속 체내 면역세포가 인식할 수 있는 Fc부분을 갖고 있는데 만약 KDR 발현이 혈관내피세포에 국한되지 않을 경우 상당한 장점을 갖게 된다.
가령 성격이 급한 암 덩어리는 혈관내피세포에 발현하는 KDR을 자기자신 그리고 ‘암세포 유모세포’라고 불리는 스트로마 세포에까지 발현하기도 한다. 이 때 타니비루맵이 KDR에 결합해 암세포에 붙어 있으면 면역세포는 타니비루맵의 Fc부분을 인식한 후 암세포 세포사멸(apoptosis)이나 세포괴사(necrosis)를 유도할 수 있다. 즉 직접적인 신생혈관형성 억제 이외에도 면역세포를 통해 암덩어리를 공격하게 유도할 수 있는 것이다.
글로벌 시장에서 타니비루맵과 '신생혈관형성 억제'라는 유사기전을 가진 항체치료제에는 아바스틴(Avastin)이 있으며, 이 항체치료제는 2015년 기준 7조원의 매출을 올린 글로벌 항암제다. 타니비루맵이 가진 별명은 ‘차세대 아바스틴’, 유 대표는 “타니비루맵 효과는 아바스틴보다 훌륭할 것”이라고 자신했다.
◇7조원 시장가진 아바스틴을 역사속으로? 넘어설 수 있는 이유
그렇다면 유 대표가 아바스틴을 넘어설 수 있다고 말하는 이유는 무엇일까? 그 답은 아바스틴과 타니비루맵이 타깃으로 하는 분자기전 차이에 있다.
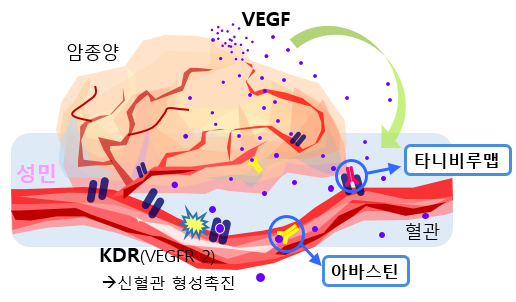
아바스틴은 VEGF-a를 타깃으로 하는 항체(anti-VEGF-a antibody)로 언뜻 보기엔 두 약물 다 VEGF-KDR 신호 전달을 막는 것처럼 보이지만 실제 상당한 차이가 있다. 기전차이에서 생기는 아바스틴의 한계는 다음과 같다.
첫째 환자에게 약물복용 시 생기는 내성문제다. 아바스틴은 VEGF-a에 결합해 신호전달을 억제하는데 처음에는 약물 효능이 좋지만, 이 상태가 지속될 경우 암세포는 VEGF-b, c, d, e까지 분비를 해 아바스틴의 작용을 무력화시킨다. 때문에 실제환자에서도 아바스틴을 단독으로 쓰기보단 병용요법으로 증상을 완화하는 용도로 쓰이며 내성이 생겨 다른 약물로 교체를 하는 경우도 발생한다. 반면 타니비루맵은 KDR에 붙는 VEGF-a, c, d 관련 신호전달을 막을 수 있기에 더 폭넓게 쓰일 수 있다는 설명이다.
다음으론 억제 효율이다. 암세포는 아주 끈질겨 웬만해선 죽지 않는데 저산소 스트레스를 받을 경우 폭발적으로 VEGF를 발현하기에 이를 효과적으로 막기 위해선 VEGF보다 높은 농도의 항체가 필요하다는 것. 타니비루맵은 수용체를 막기 때문에 같은 양의 아바스틴보다 효율적으로 작용하게 된다.
마지막으론 정상 면역세포를 억제하는 경우다. VEGF-a는 KDR외에도 다른 수용체 타입인 VEGFR-1에도 결합할 수 있는데, 이 신호전달은 백혈구의 일종인 단핵구의 증식∙활성화에 중요하다고 알려져 있다. 즉 환자 면역체계를 억제할 수도 있다는 것. 결론적으로 타니비루맵은 VEGF-KDR 관련 신호전달을 ‘더 특이적으로’ 막을 수 있어 아바스틴을 대체할 수 있을 것이란 설명이다.
시장에 KDR을 타깃으로 하는 항체는 없을까? 사이람자(Cyramza)는 2014년 FDA승인을 받는 위암 항암치료제로 타니비루맵과 KDR을 막는다는 점에서 작용 기전이 같다.
타니비루맵이 사이람자와 비교했을 때 갖는 차별성은 ‘이종간 교차 반응성’이다. 쉽게 이야기하면 타니비루맵은 인간 또는 쥐 유래의 VEGFR-2에만 결합 가능하나, 사이람자는 인간유래 VEGFR-2에만 결합 가능하다. 이러한 특성이 의미하는 바는 쥐에 환자의 암덩어리를 이식했을 때 생성되는 신행혈관에 대해서 타니비루맵은 신생혈관 형성 억제 효능을 나타낼 수 있지만 사이람자는 확인할 수 없다는 뜻이다. 이처럼 VEGFR-2를 표적으로 하는 완전인간항체가 인간이 아닌 설치류의 그것에 붙을 수 있는 것은 타니비루맵이 유일하다는 설명이다.
한편 환자 유래 암세포를 가진 동물모델은 어느 정도는 실제 암환자를 대변할 수 있다. 특히, 같은 암을 가진 환자에서도 암세포는 너무나도 다른 특징(heterogeneous)을 갖고 있어 임상에 들어가기 전 타니비루맵에 좋은 반응성을 보이는 환자들을 미리 선별하고, 이러한 환자들에게 적절한 병용요법을 처방하는 용도로 사용된다면 유용할 수 있다. 즉, 환자에 따라 더 맞게 타니비루맵을 쓸 수 있는 장점이 있다는 것이다. 새로운 암 치료제로 각광을 받고 있는 면역관문억제제의 경우에도 효과를 나타내는 환자는 20% 수준에 그친다.
유 대표가 ‘타비니루맵이 향후 큰 시장성을 갖는다’고 주장하는 또 다른 근거는 아바스틴과 사이람자, 잘트랩 등을 포함하는 VEGF 억제제에서 공통적으로 나타나는 고혈압, 내부 과출혈, 폐, 위장관 천공과 같은 부작용이 없다는 장점 때문이다. 다만, 타니비루맵은 임상 1상과 현재 진행중인 호주 임상 2a상 환자에서 가역성 피부모세혈관종이 대표적인 부작용으로 확인되고 있다.
◇타니비루맵, 어디에 적용할 것인가…그 가능성은?
파멥신은 호주에서 재발성 악성교모세포종(Glioblastoma, GBM)으로 임상 2a를 진행중이다.
재발성 교모세포종은 특별한 치료법이 없는 악성 뇌종양으로 항암 치료에 대한 저항성이 높아 생존기간이 14개월에 불과하다. 재발성 교모세포종은 표준 치료법이 없으며 아바스틴이 부종크기를 줄여주기 때문에 사용하고 있지만 치료개념이 아닌 일시적으로 종양의 성장을 억제하는 기능을 한다. 하지만 전체 생존율에 미치는 효과는 미미하다. 때문에 타니비루맵은 치료제가 절실한 악성교모세포종 시장을 노리겠다는 전략이다.
회사가 이 적응증을 선택한 근거는 비임상 실험결과다. 전임상 GBM Orthotopic모델 및 PDX 동물모델에서 타니비루맵이 아바스틴에 비해 효능이 훨씬 뛰어났으며 아바스틴과 CPT-11을 병용투여 한 경우에서도 타니비루맵 단독 투여에서 종양감소 효과가 더 우수했다.
유 대표는 항체치료제의 BBB(Blood-Brain barrier, 혈뇌장벽) 통과 여부에 대해서도 “일반적인 경우는 항체 치료제는 BBB를 통과하지 못하지만 교모세포종 환자의 경우 이미 BBB가 일부 망가진 상태"라며 "실제 약물진입에는 문제가 없는 것을 확인했다”고 전했다.
비슷한 예로써 에브비에서 개발 중인 암세포 성장을 억제하는 ABT-414의 경우 항체에 약물을 부착한 ADC(antibody drug conjugate, 항체-약물 결합체)임에도 불구하고 GBM환자에서 BBB를 잘 통과한다는 것이 보고된 바 있다. 아바스틴 역시 악성교모세포종 환자에서 BBB를 통과해 부종억제 효과를 가진다.
유 대표는 타니비루맵 적응증 확대에 대해 향후 삼중음성 유방암(Triple negative breast cancer)에서 임상시험 진행을 하고 있다고 밝혔다.
삼중음성 유방암은 에스트로겐 수용체, 프로제스테론 수용체와 HER2의 발현이 모두 음성인 유방암으로 전체 유방암 중 약 15%를 차지한다. 삼중음성 유방암은 재발이 잦고 뇌, 뼈로 전이가 잘 돼 HER2 음성 유방암 중에서도 예후가 가장 나쁜 암종으로 알려져 있다. 문제는 아직 마땅한 치료약이 없다는 것. 아바스틴과 사이람자 모두 HER2 음성 유방암 임상시험에서 실패했다.
그런데 삼중음성 유방암 머우스 질환동물모델에서 타니비루맵이 아바스틴보다 우수한 효과를 나타내고 있다. 현재 아산병원과 공동으로 진행중인 연구에서는 2 mg/kg의 동용량에서 아바스틴은 51%의 종양 성장억제 효과를 보인 반면, 타니비루맵은 71 %의 종양성장 억제능력을 보여주었다. 아바스틴과 사이람자가 Her2 음성 유방암에서 허가를 받지 못한 점을 고려하면 향후 타니비루맵이 삼중음성 유방암 치료제로 쓰일 가능성을 보여준다는 설명이다.
또한 재발성 교모세포종에서 효과를 확인할 경우 타깃 적응증이 뇌전이까지 확대될 수 있음을 내비쳤다. 뇌전이는 유방암, 폐암, 간암을 포함한 말기 암환자에서 공통적으로 나타나는 증상으로 결과적으로 암은 뼈, 뇌로 전이되며 결국 환자가 사망하게 되는 원인으로 알려져 있다.
◇국내 임상2a 자진 철회, 호주로 시선 돌리게 된 이유는
타니비루맵은 2011년 11월부터 2013년 9월까지 26명의 대장암 환자를 포함한 난치성 고형암 환자를 대상으로 삼성병원에서 임상 1상을 진행했다. 그리고 임상 1상에서 약물 ‘안전성’ 문제에 따른 식약처의 우려에 국내 임상 2a상 진입을 자진철회하였다.
주요 쟁점은 26명 임상1상 환자 중 15명에서 1~5급(사망위험) 중 낮은 단계인 1~2급 피부모세혈관종(reversible capillary hemangioma on the skin)이 나타난 임상결과였다. 이들의 경우 체내 타니비루맵 농도가 낮아지면 다시 없어지는(reversible) 것으로 세심한 주의를 통해서 임상진행이 가능할 것으로 기대하였으나, 동물모델에서 MOA(mode of action, 작용기전)를 밝힐 것을 권고 받았다.
하지만 정작 문제는 전임상에서 쥐, 원숭이를 이용한 동물실험에서 고용량의 타니비루맵을 투여하더라도 환자에서와 같이 혈관종의 부작용이 나타나지 않았다는 데 있었다. 이에 대해 식약처의 입장은 단호하였으며, 파멥신은 결국 혈관종 동물모델 수립의 한계에 부딪혀 국내 임상 2a상 개발임상(IND) 신청을 자진철회했다.
혈관종은 비정상적인 혈관이 뭉쳐 있는 덩어리를 지칭하며 가장 흔하게 나타나는 것이 유아혈관종으로 혈관내피세포가 빠르게 증식해 생겼다가 나이가 들면서 대부분 자연 소멸된다고 알려져 있지만 정확한 생성 기전은 밝혀지지 않았다.
그렇다면 신생혈관 억제제인 타니비루맵 처방환자에서 왜 혈관종이 나타난 것일까? 회사측 설명에 따르면 암세포 혈관생성에 필요한 KDR(VEGFR-2) 신호 전달이 차단될 경우, 풍선효과로 VEGFR-1, 3와 같은 다른 혈관생성 인자가 과활성화 될 수 있다는 것. UCB Pharma에서 진행했던 CDP-791도 KDR을 타깃으로 하는 항체치료제로 임상 1상에서 35% 환자에서 혈관종이 나타났지만 임상 2a상를 허가 받은 바 있다.
유 대표는 혈관종 안정성 문제에 대해 “현재 호주에서 12명 환자에게 임상 2a상을 진행 중이며 1급, 2급 피부모세혈관종이 환자들 사이에서 발생해 예의주시하고 있는 중이다. 이후 생체검사(biopsy)를 할 만한 수준이 나오면 생체조직에서 서열검사(sequencing)를 할 것”이라 언급했다.
실례로 사이람자를 복용한 환자에서 4센티미터 크기의 혈관종이 나타난 경우가 있었는데 조직을 서열분석 해본 결과(Lim YH, 2015) KDR에 돌연변이가 생겨 VEGF 없이도 마치 VEGF가 결합한 것 같은 가짜 활성화(false positive response)가 돼있었다는 설명이다. 즉 암세포 미세환경에서 혈관종을 일으키는 요소는 매우 다양할 수 있음을 짐작할 수 있다.
◇타니비루맵도 뛰어넘을 이중항체, DIG-KT
회사의 향후 가치는 타니비루맵에 국한되지 않는다. 파멥신은 타니비루맵에서 한 걸음 더 나아가 이중표적항체 플랫폼 및 이를 바탕으로 한 다양한 조합의 이중표적항체 파이프라인을 보유하고 있고, 대표적인 예로 DIG-KT(PMC-001)가 있다.
이중표적항체 플랫폼은 현재 전 세계적으로 약 70여종 이상이 개발되고 있으며, 그 형태와 기능 또한 아주 다양하다. 크게 하이브리드식으로 두 개의 팔이 각각 다른 표적을 잡는 경우가 있고 각각의 팔이 동시에 두 개 표적을 잡을 수도 있다. DIG-KT는 후자의 경우로 타니비루맵울 근간으로 하여 KDR을 표적으로 하는 것 외에 추가적으로 Tie-2를 잡겠다는 의도에서 개발된 항체치료제이다. Tie-2는 KDR와 같은 신생혈관형성을 촉진하는 수용체로 두 기전을 모두 막을 경우 더 효과적으로 암세포 증식∙전이를 막을 수 있을 것이란 설명이다.
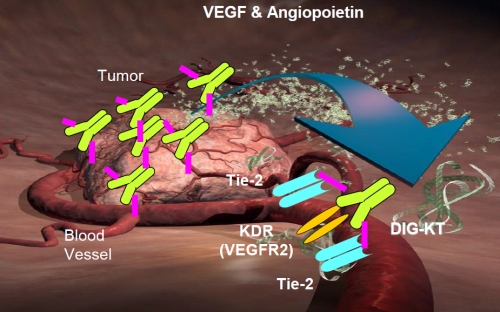
▲출처: 파멥신 제공
실제 비임상 연구결과 간암 세포주가 이식된 동물모델에서 타니비루맵 대비 더 뛰어난 효과를 나타내는 것을 확인했으며, 악성뇌종양이 이식된 아바스틴 저항성 질환 모델에서 종양억제 효과가 있음을 확인했다.
유 대표는 “최고로 좋은 약은 없다고 생각한다. 그 시점에서 최고일 뿐이지 시간의 흐름에 따라 사이언스가 발전하고, 이에 따라 약의 효능과 안전성은 더 개선되기 때문”이라면서 “그래서 개인적으로 최적이라는 말이 맞는 거 같다. 우리는 최적의 차세대 치료제를 환자에게 제공하겠다”라고 강조했다.
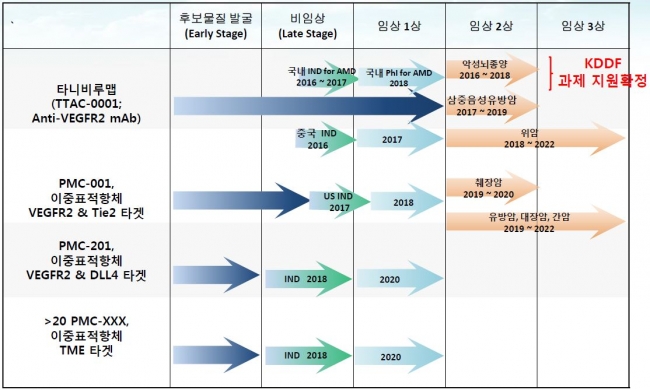
▲파이프라인 진행상황출처: 파멥신


















