국제
SMA치료제 '스핀라자' 가격논란...1회 주사에 "1억5천만원"
바이오스펙테이터 김성민 기자
"희귀질환 SMA환자에게 너무 큰 부담" vs "임상적 가치 충분...향후 R&D비용 필요"
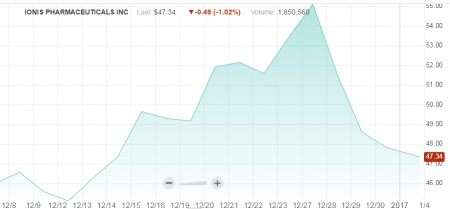
▲바이오젠 가격공개 후 하락한 아이오니스 주가나스닥 참고
1회 주입에 1억 5000만원(12만 5천 달러). 첫해 6회 주입 그리고 다음해부터 3회 주입을 계산한다면, 한 환자가 첫해 지불해야 되는 돈은 75만 달러이고 이후 37만 5000달러를 지불해야 되는 셈이다.
이는 작년 12월 23일, 치료제가 없는 희귀병인 척수성 근위축증(SMA, spinal muscular atrophy)에서 최초로 FDA(미국 식품의약국) 승인을 받아 주목을 받았던 '아이오니스(IONIS)의 스핀라자(SPINRAZA, 제품명)' 투여가격이다. 판권을 갖고 있는 바이오젠이 28일 스핀라자 가격을 발표한 후 아이오니스의 주가가 연이어 하락하고 있다.
바이오젠-아이오니스가 지난 11월 매우 성공적인 스핀라자 임상3상 결과를 발표, 신속허가절차에 들어간 후 두달 만에 FDA의 승인을 획득하면서 많은 기대를 모았던 치료제인 만큼 '환자에게 너무 부담이 큰 투여가격'으로 큰 논란에 휩싸이고 있다.
그러나 Matt Fearer 바이오젠 대변인은 CBS 뉴스에서 "매우 신중하게 가격을 책정한 것"이라는 의견을 전달했다. 그는 스핀라자의 임상적 가치와 향후 바이오젠의 R&D 자금조달을 고려해 봤을 때 "다른 희귀병 치료제와도 크게 다르지 않다"고 언급했다.
바이오젠에 따르면 미국에서 SMA환자는 9000명으로 추산되며, 유럽은 1만명 그리고 일본에 1000명의 환자가 있다고 추정된다. SMA는 매우 심각한 운동신경질환으로 유아에서 SMA가 나타날 경우 두살을 넘기기 힘들다고 알려져 있다. 그렇기에 SMA과 같은 '더 드문 희귀병치료제(Ultra-orphan drug)'은 환자수가 적으면서, 신약개발을 하는 제약사 입장에서 재정적 압박이 클수 밖에 없다는 것.
스핀라자가 더욱 주목받았던 이유는 임상3상에서 '매우 우수한 임상결과'를 바탕으로 이룬 성과인데다 아직까지 상업적으로 성공한 RNA 치료제가 없기에, 시장에 출시될 경우 연간 매출이 10억달러가 넘는 블록버스터 의약품으로 평가 받았기 때문이다.
스핀라자의 임상3상(CHERISH) 결과를 보면, 운동능력을 평가하는 1차 기준점(endpoint)인 FMSE(Hammersmith Functional Moter Scale Expanded)에서 매우 유의미한 결과(p<0.0001)를 얻었다. 임상3상은 Type 1, 2, 3으로 2-13세 126명 SMA 환자를 대상으로 진행되었으며 15개월 차에 평균 4점에 달하는 향상을 보였고, 치료를 받지 않은 환자들의 경우에는 평균 1.9점 감소했다. 약물투여에 따른 특별한 부작용은 나타나지 않았다.
안티센스 치료제인 '스핀라자'가 겨냥하는 SMA는 매우 심각한 운동신경질환으로 SMN1(survival motor neuron 1) 유전자 상에 결실(deletion) 혹은 결함이 생기거나 SMN 단백질의 발현양이 감소해 나타난다. 이에 스핀라자는 SMN2가 단백질로 발현되기 전 선구물질인 pre-mRNA에 결합해 기능을 할 수 있는 SMN 단백질 발현양을 늘리는 원리다.
이처럼 치료제가 없는 SMA시장에 아이오니스가 침투할 수 있었던 이유는 기존 치료제가 접근하기 힘든, pre-mRNA를 겨냥하는 RNA치료제이기 때문이다. 아이오니스는 바이오젠 이외에도 GSK, Akcea, 로슈와 공동으로 다양한 희귀병치료제 파이프라인을 진행 중이다.
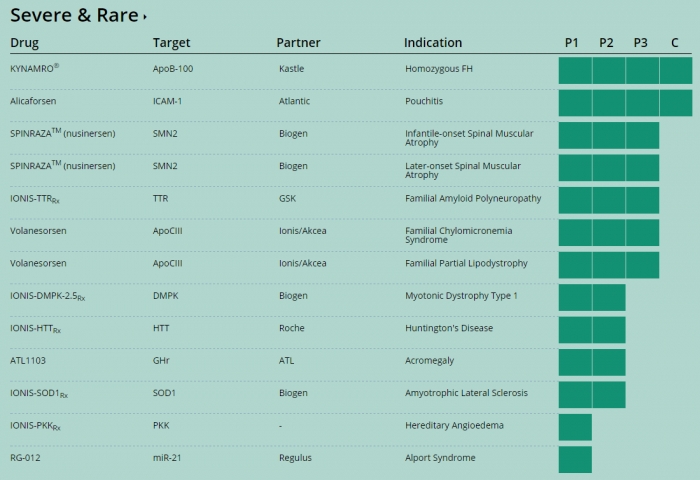
▲아이오니스 홈페이지 참고
희귀질환이 대부분 유전자 수준의 결함에 기인했기에, 이를 타깃으로 한 RNA치료제 개발이 활발하다. 국내에서는 올리패스가 희귀병인 뒤센 근위축증(DMD, Duchennes Muscular Dystrophy)에서 RNA치료제 후보물질을 개발중이다. 한편 올리패스는 작년 11월 ‘올리패스 올리고뉴클레오티드(OliPass Oligonucleotide)’를 기반으로 한 비마약성 진통신약이 (재)범부처신약개발사업단(KDDF) 사업 과제에 선정된 바가 있다.


















