국제
中바이오사이토젠, ‘인간항체’ 발굴 플랫폼 경쟁력은?
바이오스펙테이터 노신영 기자
독자적인 완전(fully) 인간항체 마우스모델 “RenMice™” 토대로 항체신약 발굴 및 개발 플랫폼 갖춰.. 글로벌 합작기회 모색

중국 바이오사이토젠(Biocytogen, 百奥赛图) '완전인간항체' 플랫폼을 토대로 항체신약을 전문적으로 발굴하고 있는 바이오텍이다. 초기에는 유전자 편집기술을 활용해 전임상시험에 사용할 수 있는 다양한 마우스 모델을 개발하던 회사였으나, 이후 인간항체를 생산하는 마우스 모델을 토대로 항체 발굴 플랫폼을 구축했고 현재는 발굴 뿐만 아니라 자사 플랫폼을 활용해 자체적으로 항체신약을 개발하고 있다.
국내에는 잘 알려지지 않았지만 바이오사이토젠은 지난 2009년 첫 중국 베이징 본사설립 이후 2014년 신약개발 및 동물모델 생산을 위한 장쑤성 하이먼시(海门市) 생산지부 설립, 2018년 미국 진출을 위한 보스턴 지사설립 등 꾸준히 사업을 확장하고 있다. 또한 항체신약 연구개발을 집중적으로 진행하기 위해 지난 2016년 베이징에 자회사 유큐어 바이오파마(Eucure Biopharma)를, 뒤이어 2018년에는 보스턴에 유큐어 바이오파마 보스턴(Eucure Biopharma Boston Corp)을 설립해 본격적인 항체신약 임상개발에도 힘을 쏟고 있다.
이에 바이오사이토젠은 지난 2020년 9월 시리즈D+로 1억4200만달러를 유치했으며, 약 1년뒤인 지난 8월 말 홍콩증권거래소(HKEX)에 상장신청서를 제출하며 본격적인 IPO 준비에 나섰다.
현재 바이오사이토젠은 크게 4가지 사업부문 ▲유전자 편집 ▲항체신약 개발 ▲인간항체 발굴 ▲전임상 CRO서비스 등을 운영하고 있다. 이들 4개 사업부문은 바이오사이토젠의 플랫폼 및 기술을 토대로 유기적으로 이어져 있다. 예를들어 바이오사이토젠은 유전자 편집 기술을 활용해 인간항체 마우스 모델을 개발했으며(RenMice™), 확보한 인간항체 마우스 플랫폼을 활용해 대규모 항체신약 스크리닝 프로젝트(Project Integrum)를 진행하고 있다.
바이오스펙테이터는 바이오사이토젠의 경쟁력을 볼 수 있는 항체 기술플랫폼에 대해 알아봤다. 특히 바이오사이토젠의 광범위 서비스에 다방면으로 응용되고 있는 유전자 편집기술과 독자적인 인간항체 발굴 플랫폼 ‘RenMice™’ 그리고 대규모 항체신약 스크리닝 프로젝트(Project Integrum)를 중심적으로 살펴봤다.
독자적 유전자 편집기술에서 동물모델∙세포주(cell line) 개발까지
바이오사이토젠은 설립초기부터 독자적인 유전자 편집 기술을 확보함으로써 유전자 편집 서비스, 실험동물 모델, 세포주 제작 등 다양한 서비스를 개시했다. 2011년 마우스 배아줄기세포 DNA의 상동재조합(Homologous Recombination) 기술 ‘ESC/HR’을 토대로 첫 유전자 편집 서비스를 시작했으며 이후 2014년 CRISPR/Cas9 기술을 바탕으로 타깃 유전자의 녹인(knock-in) 효율을 약 20배 높인 ‘EGE(Extreme Genome Editing system)’ 기술을 개발했다. 바이오사이토젠은 특정 동물모델을 제작함에 있어서 EGE가 CRISRP/Cas9 시스템의 장점을 바탕으로 높은 유전자 편집효율과 타깃 정확도를 확보할 수 있도록 개발했다고 설명했다.
EGE 유전자 편집기술을 바탕으로 바이오사이토젠은 2014년 심각성 면역결핍 마우스 모델 ‘B-NDG™’과 다양한 인간화 면역체크포인트(immune checkpoint humanized) 마우스 모델을 제작해 확보했다. 본격적인 실험동물 및 세포주의 개발과 생산을 시작한 것이다. 회사측의 설명에 따르면, 바이오사이토젠은 현재 인간화 동물모델부터 종양, 대사, 자가면역질환 세포주까지 전세계지사에서 2500여개의 마우스 모델 및 세포주 프로그램을 확보하고 있다.
또한 바이오사이토젠은 확보한 마우스 모델을 토대로 항체신약 개발을 위한 전임상 서비스 플랫폼을 구축했다. 현재 바이오사이토젠은 유전자 편집, 전임상 약리학(pharmacology) 및 약물 효능평가, 동물모델 판매, 항체개발까지 전반적인 전임상 연구개발 서비스를 제공하고 있다. 이러한 CRO 서비스의 수요는 지속적으로 증가하고 있어 바이오사이토젠의 매출에 상당수준 기여하고 있으며, 향후 CRO 서비스 시장확장에 따른 매출 성장을 기대하고 있다.
바이오사이토젠의 또 다른 유전자 편집기술 SUPCE(Size-Unlimited and Precise Chromosome Engineering system)은 대규모의 DNA 서열 또는 유전체를 치환하는 기술이다. 긴 유전자 단편을 편집하려는 경우, 편집 가능한 유전자 사이즈의 한계가 있어 여러번 편집과정을 거쳐야 한다. 바이오사이토젠은 특히 동물모델을 확보하기 위해 마우스 배아세포를 대상으로 대규모 유전자 편집을 진행하는 경우, 세포가 체외에 장기간 노출되면서 유전자 기능을 잃는 일이 번번히 발생했기 때문에 편집 횟수에도 제한을 받게 된다고 강조했다.
바이오사이토젠은 이를 극복하기 위해 편집하려는 유전자의 길이와 상관없이, 100Mb(base pair) 규모에 해당하는 전염색체를 통째로 치환하는 방법을 채택했다. SUPCE는 편집하고자 하는 유전자 길이에 관계없이 3번의 편집과정 만으로 타깃 유전자의 치환에 성공했으며, 바이오사이토젠은 이를 통해 인간 항체 가변부위 서열을 통째로 치환시킨 마우스 모델 ‘RenMice™’를 확보할 수 있었다. RenMice™는 현재 바이오사이토젠의 주력 인간항체 발굴 플랫폼으로 활용되고 있다.

▲RenMice™의 Heavy chain, Light chain 유전자 구조(바이오사이토젠)
'완전' 인간항체 발굴 마우스모델 – “RenMice™”
항체의약품 개발 측면에서 인간항체 약물은 실제 약물을 적용하는 환자들을 대상으로 높은 타깃 결합능력과 실질적인 치료효능을 유지할 수 있기 때문에, 완전한 인간항체를 확보하는 것이 항체의약품 개발에 필수적인 단계가 됐다. 때문에 인간항체에 대한 연구개발 및 제조생산 능력을 갖춘 바이오텍일수록 높은 신약개발 경쟁력을 확보할 수 있다.
바이오사이토젠은 항체의약품 개발 회사로서 독자적인 ‘완전한(fully)’ 인간항체 발굴 플랫폼 ‘RenMice™’를 확보하고 있다고 강조한다.
앞서 말한 SUPCE는 메가베이스(mega-base) 규모에 해당하는 유전자 또는 염색체 치환이 가능한 유전자 편집 기술로 바이오사이토젠은 SUPCE 기술을 토대로 마우스의 항체유전자와 인간 항체유전자의 in situ 유전자 치환(gene replacement)을 진행함으로써 인간 항체 가변서열 유전자를 온전히 갖는 마우스 모델 ‘RenMice™’를 확보했다. 반면 마우스 항체의 Fc 유전자 부위는 그대로 보존해 마우스의 체내 B세포 면역반응을 정상적으로 유발시켜 투여 항원에 대한 항체를 생산할 수 있도록 디자인했다.
바이오사이토젠은 자사 RenMice™ 플랫폼을 생산하는 항체 종류에 따라 ‘RenMab’, ‘RenLite’ 플랫폼으로 세분화했다.
첫번째 플랫폼은 완전 인간항체(fully human antibody) 마우스모델 RenMab으로, Fc 유전자 부위를 제외하고 인간 항체 유전자 서열을 확보하고 있는 마우스 모델이다. 때문에 RenMab을 통해 1차적으로 생산된 항체는 인간항체의 가변부위와 마우스 항체의 불변부위(constant region)가 결합된 형태다. 이후 마우스항체의 불변부위를 인간항체 불변부위로 치환하면 완전한 ‘인간항체’를 확보할 수 있다.
기존 야생형(wild type) 마우스 모델을 통한 인간화 항체생산 과정의 경우 마우스항체의 가변부위 영역(Variable framework)을 인간항체 가변부위 영역으로 변환시켜야 하며, 이렇게 만들어진 인간화(humanized) 항체는 마우스항체의 가변부위 영역이 일부 남아있어 인간항체와 90%의 유사성을 갖게 된다. 즉, 불완전한 인간항체 구조로 인해 실제 인간항체보다 항원 결합능이나 항체 효능이 저하될 위험이 발생한다. 때문에 RenMab 플랫폼을 통해 생산된 항체는 실제 인간항체 가변부위 유전자를 토대로 항체를 생산하기 때문에 별도의 인간화 과정이 필요없으며, 높은 항원 결합력(affinity), 낮은 면역원성(immunogenicity) 그리고 해당 항체를 실제 임상 연구개발에 쉽게 적용할 수 있다는 점이 강점이다.
두번째 플랫폼은 이중항체 마우스모델 ‘RenLite’이다. RenLite의 경우 마우스의 중쇄(heavy chain) 가변부위 유전자 부위가 인간 중쇄 유전자로 치환됐으나 마우스의 경쇄 가변부위 유전자는 단일 인간 카파 경쇄(kappa light chain) 유전자로 대체된 마우스를 활용한다. 결과적으로 RenLite를 통해 합성된 항체 역시 완전한 인간항체가 된다.
RenLite를 통해 합성된 항체는 경쇄부위가 고정된 레파토리를 갖지만, 중쇄는 여전히 항원을 대상으로 다양한 인간 항체를 생산할 수 있기 때문에, 각기 다른 두 항원에 대해 생산된 항체간 중쇄조합(assemble) 과정을 통해 인간 이중특이적 항체를 제작하게 된다. 바이오사이토젠은 이 과정에서 두 항체들이 경쇄 상보성(complementarity)을 유지하며 경쇄-중쇄간 불일치 문제도 없어 합성된 이중항체의 추후 CMC(chemistry, manufacturing, and controls) 개발과정이 용이하다고 설명했다. 바이오사이토젠은 RenLite를 통해 이중항체와 이중 특이적 항체-약물 접합체(ADC)을 제작하고 있으며, 자체 개발중인 ADC 파이프라인(YH012, YH013)의 개발에도 RenLite 플랫폼을 활용하고 있다.
인간항체 마우스 모델 RenMab과 RenLite 마우스는 다양한 항체신약의 개발에 활용되고 있다. 현재 바이오사이토젠은 준시 바이오사이언스(Junshi Biosciences), 이노벤트 바이오로직스(Innovent Biologics), 젠코(Xencor) 등 다양한 글로벌 바이오텍과 항체 신약발굴 파트너십을 체결했다. 지난해 9월에는 국내 항암신약 개발회사 유틸렉스(Eutilex)와 항체신약개발 업무협약(MOU)을 체결하며 본격적인 국내 파트너십을 시작했다.
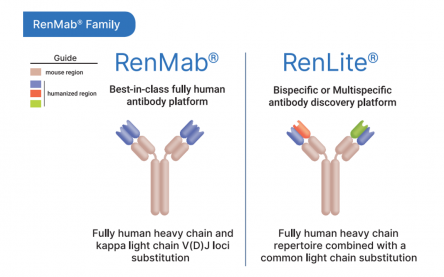
▲RenMab Family(바이오사이토젠)
RenMice™ 기반 대규모 항체 발굴 프로젝트 ‘Project Integrum’
기존 약물개발 단계는 약물작용기전(MOA)이 명확한 타깃에서부터 연구를 시작했다. 약물표적의 MOA를 토대로 타깃단백질의 규명, 발굴, 리드 항체의 최적화 그리고 그 이후의 전임상, 임상 연구단계가 이뤄지게 된다. 그러나 약물표적의 MOA를 완전히 규명하기는 어렵기 때문에 많은 연구자들과 바이오텍이 신약개발에 어려움을 겪게된다. 시장조사기관 '프로스트 앤 설리반(Frost & Sullivan)’에 따르면 아직 인체에는 1000여개 이상의 약물표적이 있으며, 1986년 면역억제용 첫 항체치료제 ‘muromonab-CD3’가 승인된 이후 미국 식품의약국(FDA)과 유럽의약품청(EMA)은 약 60개표적에 대한 144개 항체치료제를 승인한 상태다.
바이오사이토젠은 아직 개발되지 않은 잠재적인 항체 약물표적을 확인하며, 새로운 항체치료제를 발굴하기 위해 지난 2020년부터 자사 RenMice™ 모델을 활용한 in vivo 대규모 인간항체 스크리닝 프로그램 ‘프로젝트 인테그럼(Project Integrum, 千鼠萬抗)’을 진행하고 있다.
Project Integrum은 RenMice™ 마우스의 1000여개 표적유전자를 녹아웃(knock out) 시킨 RenMice™ 녹아웃 마우스 라이브러리로부터 시작한다.
표적유전자가 녹아웃된 RenMice™는 항원주입에 따른 면역반응을 유발시켜 해당 단백질(항원)에 대한 다양한 항체를 생산하게 된다. 항체는 마우스의 면역시스템을 토대로 표적 단백질의 다양한 에피토프 부위를 타깃하기 때문에 일반적인 방법으로는 타깃할 수 없는(undruggable) GPCR/이온채널단백질 등을 대상으로도 항체발굴이 가능하다.
확보한 항체는 인간, 마우스 등 다종(multi species) 항원에 대한 교차면역반응을 통해 다종항원에 친화력이 보편적으로 높은 항체를 스크리닝해 선별한다. 녹아웃 RenMice™을 통해 확보한 타깃 항체는 각 표적당 400~600여개의 항체클론이 선별되며, 인간과 마우스 항원에 대한 교차인식(cross-recognize)을 진행해 표적당 100~200개의 항체분자를 재선별한다.
이후 in vivo 효능평가를 진행해 타깃 질환에 대해 높은 치료효과를 보이는 항체를 최종 10~20여개 선별하게 된다. 이때, 바이오사이토젠은 마우스 모델을 대상으로 확인한 항체효능 한계를 고려해 영장류 등 더 큰 동물을 대상으로 항체의 추가적인 효능검증을 거치게 된다. 현재 바이오사이토젠은 마우스를 제외한 실험동물의 항암중개연구(medical translation) 기관을 건설중이라고 밝혔다. 최종적으로 선별된 항체 후보물질은 임상시험에 진입하게 된다.
Project Integrum을 통한 in vivo 스크리닝 과정은 신약발굴 및 개발 과정을 단축시켜 기존 약물발굴 접근법 대비 초기 약물개발 과정에 걸리는 시간을 획기적으로 줄였다고 설명했다. 초기 약물개발 단계에 해당하는 표적연구, 시험관 내 분석 및 약물개발, 표적검증, 항체 인간화, 리드 후보물질 스크리닝 및 최적화 단계에 소비되는 기간이 평균 5.5년이라면, Project Integrum을 통한 초기 약물개발 단계는 표적 녹아웃 마우스 모델을 통한 항체발굴, 표적단백질 결합능에 따른 후보물질 선별, 마우스 생체 내(in vivo) 효능평가를 통한 최적후보 선별 및 기타 실험동물 대상 교차 종(species) 검증 단계로 간소화됐다. 결과적으로 Project Integrum을 활용한 항체 스크리닝은 12~18개월까지 시간을 단축할 수 있으며, 안전성 및 효능 측면에서도 충분히 검증된 항체를 확보할 수 있다.
바이오사이토젠은 Project Integrum을 활용한 인간항체 스크리닝을 진행하며 심혈관, 위장, 염증 및 자가면역, 대사, 전염병 등 13개 질환분야를 대상으로 총 980개의 표적유전자의 녹아웃 연구를 진행했다. 또한 현재 15개의 타깃을 대상으로 항체 후보물질을 선정하고 있으며, 앞으로 3~5년 사이 목표했던 대로 총 1000여개 타깃에 대한 항체 후보물질을 차례대로 도출할 계획이라고 설명했다.

▲Project Integrum(RenMice™ HiTS 플랫폼) 기반 신약발굴 프로세스(바이오사이토젠)



















