기업
HLB, ASCO서 ‘리보세라닙 병용’ 간암 “OS 23.8개월”
바이오스펙테이터 서윤석 기자
[ASCO 2024] '리보세라닙+캄렐리주맙' 병용 최종분석..전체반응률(ORR) 26.8%, 반응지속기간(DoR) 17.5개월

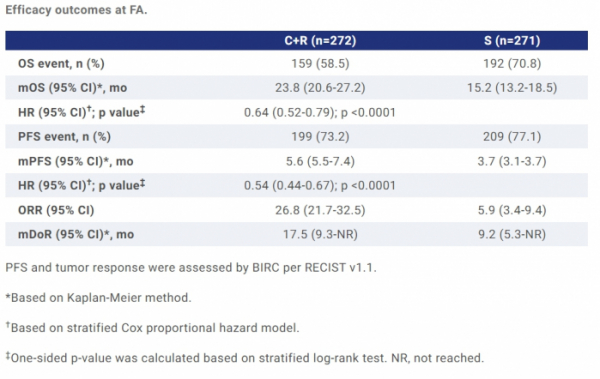
HLB는 24일 VEGFR2 TKI '리보세라닙(rivoceranib)'과 PD-1 항체 '캄렐리주맙(camrelizumab)' 병용요법 간암 임상3상의 최종 전체생존기간 중앙값(mOS)이 23.8개월으로 집계됐다고 미국 임상종양학회(ASCO)에서 초록(abstracts)을 통해 공개됐다고 밝혔다. 대조군인 소라페닙(sorafenib)의 mOS는 기존과 동일한 15.2개월로 나타났다.
공개된 초록에 따르면 mOS는 ‘리보세라닙+캄렐리주맙’ 병용투여군에서 23.8개월, 소라페닙 투여군에서 15.2개월로 통계적으로 유의미한 차이를 보였다(HR: 0.64, p<0.0001). 병용투여군에서의 OS 이점은 지리적, 인종, 병인(aetiology)과 관계없이 하위그룹 전체에서 일관되게 나타났다.
‘리보세라닙+캄렐리주맙’ 병용투여군에서 무진행생존기간 중앙값(mPFS)과 전체반응률(ORR)은 각각 5.6개월(vs 3.7개월), 26.8%(vs 5.9%), 반응지속기간 중앙값(mDoR)은 17.5개월(vs 9.2개월)로 소라페닙 투여군 대비 유의미한 차이를 보였다(p<0.0001).
이전에 발표된 결과에서 ‘리보세라닙+캄렐리주맙’ 병용요법의 mOS는 22.1개월, ORR과 mDoR은 각각 25.4%, 14.8개월로 나타났다. 소라페닙 투여군의 mOS는 15.2개월, ORR과 mDoR은 각각 5.9%, 9.2개월이었다(doi: 10.1016/S0140-6736(23)00961-3).
안전성 프로파일은 이전과 일치했으며 새로운 부작용은 보고되지 않았다.
한편 HLB의 미국 자회사 엘레바와 파트너사인 항서제약은 지난주 미국 식품의약국(FDA)으로부터 리보세라닙+캄렐리주맙 병용요법에 대해 최종보완요청서(CRL)를 받았다. 회사에 따르면 리보세라닙에 대한 지적사항은 없었고, 캄렐리주맙에 대해서는 공장설비(Facility)에 대해 미비한 점이 있어 보완이 필요하다는 내용이다. 두 회사는 곧 FDA와의 미팅 또는 통보를 통해 정확한 내용을 알 수 있을 것으로 보고있다.