기업
한독테바, 천식약 ‘싱케어’ 허가..국내 진출 이후 첫 신약
바이오스펙테이터 천승현 기자
지속형 천식치료 바이오신약..2013년 설립 이후 1호 신약ㆍ기존 판매 중인 신약은 국내 진출 이전에 허가
한독테바가 2013년 한국 시장 진출 이후 처음으로 자체개발 신약을 내놓는다.
6일 한독테바는 새로운 천식치료 바이오신약 ‘싱케어’(성분명 레슬리주맙)가 식품의약품안전처의 허가를 받았다고 밝혔다.

회사에 따르면 싱케어는 호산구의 성숙·생존·활성에 작용하는 사이토카인인 ‘인터루킨-5’를 타깃으로 하는 단일클론 항체(IgG4 kappa) 약물이다. 천식 악화의 위험인자인 혈액 내 호산구수 증가를 억제하는 역할을 한다.
싱케어는 이번 승인을 통해 국내에서 기존 치료에 적절하게 조절되지 않는 중증 호산구성 천식(치료 시작 시 혈중 호산구수: 400cells/㎕ 이상)을 가진 성인 환자에 대한 추가 유지 요법으로 사용할 수 있게 됐다. 체중에 기반해 3mg/kg의 용량으로 4주마다 1회, 20~50분 동안 정맥으로 점적 주입하면 된다.
한독테바 측은 “이번 식약처 승인은 중등도 및 중증 천식 환자를 대상으로 싱케어의 유효성과 안전성을 평가한 두 건의 위약 대조 임상연구를 토대로 이뤄졌다”라고 설명했다.
임상에 참여한 환자들은 중간용량 또는 고용량 ICS 기반 요법으로 증상이 조절되지 않고 혈액 내 호산구 수치가 400개/μL 이상이며 지난 1년간 악화가 1번 이상 발생된 12~75세의 천식 환자였다. 환자들은 같은 비율로 싱케어 또는 위약 치료군에 무작위 배정됐으며 4주마다 한 번씩 1년간 정맥 주사(3 mg/kg) 치료를 받았다.
그 결과 두 연구 모두에서 싱케어를 투여 받은 환자의 천식 악화 빈도가 유의하게 감소한 것으로 나타났다. 싱케어 치료군 477명 중에서 아나필락시스(anaphylaxis) 반응을 나타낸 환자는 2명으로 확인됐으며, 일반적 이상반응은 위약과 유사했다. 가장 흔한 이상반응은 천식 증상 악화, 상기도 감염 및 비인두염이었다.
박선동 한독테바 사장은 “이번 승인을 통해 기존 치료 요법만으로 증상이 조절되지 않았던 국내 천식 환자들에게 마침내 새로운 치료 옵션을 제공할 수 있게 되어 기쁘다”며 “출시 전부터 생물학적 천식 치료제로 국내외 많은 관심을 받았던 싱케어는 4주 1회 투여로 약효가 지속되는 장기 지속형 주사제인 만큼 주사 치료에 대한 환자들의 부담을 크게 덜 수 있을 것으로 기대한다”고 말했다.
싱케어는 지난해 최초 미국 식품의약품국(FDA) 승인을 시작으로 캐나다 보건부와 유럽의약청(EMA)의 승인을 받았다.
싱케어는 한독테바가 국내 시장에 진출한 이후 내놓는 첫 신약이다.
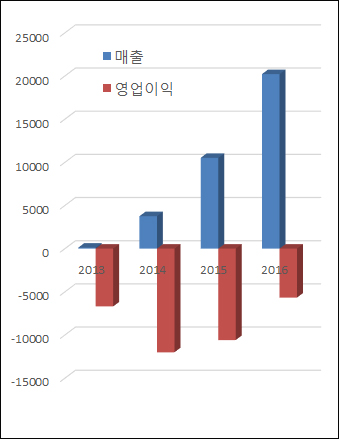
▲연도별 한독테바 매출·영업이익(단위: 백만원, 자료: 금융감독원)
글로벌 제네릭 1위 업체 테바는 지난 2013년 한독과 손 잡고 한독테바를 출범했다. 한독테바는 강점을 가진 제네릭 분야 뿐만 아니라 신약과 개량신약 영역에도 적극 뛰어들겠다는 포부를 밝혔다.
한독테바가 판매 중인 제품 중 파킨슨병치료제 ‘아질렉트’가 자체개발한 신약이지만 테바의 국내 진출 이전에 도입됐다. 룬드벡이 아질렉트의 국내 판권을 확보한 이후 테바가 한국시장에 진출하면서 한국룬드벡이 아질렉트의 국내 허가권을 갖고 있다.
한독테바와 한국룬드벡은 지난 2015년 12월 코프로모션 계약을 맺고 아질렉트의 공동 판매를 진행 중이다. ‘아질렉트’는 지난해 68억원의 원외 처방실적(유비스트 집계)을 기록하며 한독테바가 판매 중인 제품 중 가장 많은 매출을 올렸다. 테바가 개발한 신약 제품 중 '악토넬', '프로비질', '코팍손' 등도 한독테바의 국내 진출 이전에 발매된 바 있다.
한독테바는 국내 진출 이후 기존에 명문제약이 갖고 있던 자사 제품 판권을 회수하고 신제품 20여개를 출시하는 등 총 30여종의 제네릭을 발매한 상태다. 이 회사의 지난해 매출액은 202억원으로 전년(105억원)보다 92.4% 늘었다. 한독테바 측은 지속적으로 차별화를 갖춘 신약과 개량신약을 국내 시장에 내놓을 방침이다.



















