오피니언
'신항원' 잡는 新전략...TCR 이중항체 "p53, RAS까지"
바이오스펙테이터 김성민 기자
존스홉킨스의대 연구팀 'undruggable' 타깃 p53, KRAS 등 표적하는 다른 접근법과 주요 결과는...TCR 기반 치료제 개발하는 바이오텍은?
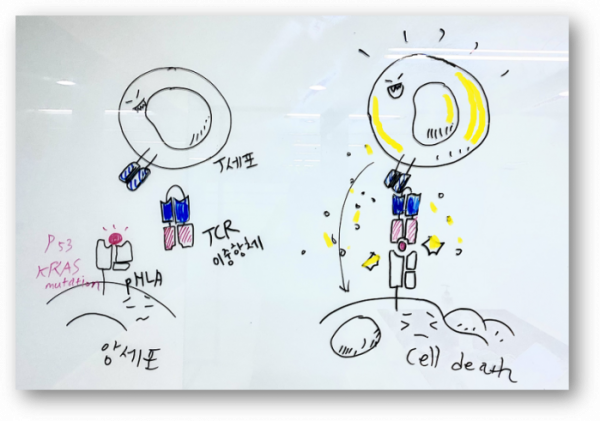
T세포를 종양부위로 끌어들이는 이중항체(T cell engager bispecific antibody)의 타깃 범위가 어디까지 확대될 수 있을까? 존스홉킨스의대 연구팀은 T세포를 끌어들이는 CD3 기반 이중항체로 기존에 표적하기 어렵다고 알려진(undruggable) KRAS 변이와 p53, 악성 T세포를 치료할 수 있는 가능성을 보여줬다.
연구팀은 각각을 타깃하는 CD3 이중항체 연구 논문 3편을 이번달 사이언스(Science) 저널에 연달아 발표했다.
논문에서 눈여겨봐야할 포인트는 4가지. 첫째, 세포내 단백질을 타깃하기 위해 TCR을 모사한 이중항체를 이용했다. 돌연변이가 생긴 신항원 단백질은 세포내 단백질 분해효소로 잘려 소포체(ER)로 이동해 항원제시 프로세스에 의해 세포막 HLA class I 분자에 8~10개의 아미노산으로 구성된 펩타이드(pHLA)로 제시된다. 기존의 세포막 단백질을 타깃하던 방식보다 약 3배가 넘는 단백질을 타깃할 수 있게 된다. 둘째, 단백질 변이 타입에 따라 다른 HLA class I 분자에 결합했고 인실리코(in silico) 컴퓨터 모델링을 통해 이를 예측했다. 예를 들어 p53 변이와 KRAS 변이는 각각 다른 HLA 분자를 통해 제시됐다. 셋째, T세포가 항원을 민감하게 인지하는 특성에 기반, 이중항체는 세포당 10개 이하로 발현하는 신항원(neoantigen)을 효과적으로 인지해 항암 효과를 발휘했다.
넷째, 연구팀은 여러 이중항체 중에서 단일사슬을 가진 디아바디(single-chain diabody, scDb)를 이용했다. 두개의 다른 타깃에 대한 가변부위가 연결된 형태(VHA-VLB-VHB-VLA)로 약 55kD 크기다. 논문에서 scDb는 BiTE(bispecific T cell engagers)나 DART(dual-affinity retargeting antibodies) 등 다른 이중항체 포맷과 비교해 T세포를 가장 효과적으로 활성화시켰다. scDb 약물이 작고, 조밀하며, 딱딱한(rigid) 특징을 가지며 종양세포-T세포와 유사한 면역시냅스를 이뤘을 가능성을 제시했다.... <계속>



















