오피니언
작년 FDA 신약 '61건', 업계 달군 "최초∙핫" 신약이슈들
바이오스펙테이터 노신영 기자
CDER 51건+CBER 10건, '40년만의 KRAS', '첫 코로나19 mRNA 백신' 등 '최초' 타이틀을 확보한 신약 '눈길'..2020년 승인불발된 블록버스터 기대 신약물질의 경과와 2021년 승인지연 약물의 이유는?
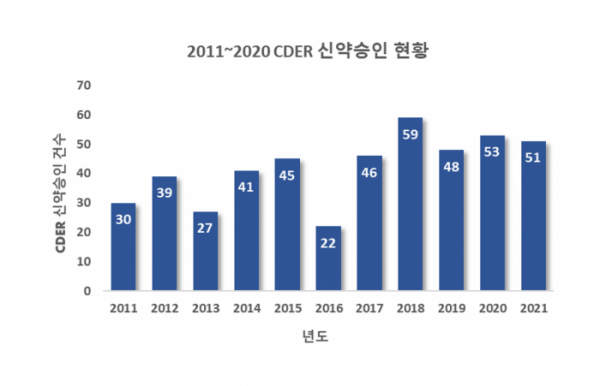
지난 2021년 미국 식품의약국(FDA)은 산하 의약품 평가연구센터(CDER)가 승인한 신약 51건, 세포치료제, 백신, 혈액제제 등 바이오의약품 평가연구센터(CBER)가 승인한 신약 10건으로 총 61건의 신약을 승인했다(▲FDA 2021년 CDER 신약허가 전체 리스트 링크, 2021년 12월 28일 기준).
회사별로 신약승인 수를 비교하면 지난 한 해 사노피(Sanofi)와 화이자(Pfizer)가 3건으로 가장 많은 신약승인을 받았다. 특히 화이자의 경우 코로나19 mRNA 백신 ‘코미나티(Comirnaty)’를 포함해 총 3건의 백신을 승인받았다. 코로나19 팬데믹의 공포에서 빠져나올 수 있다는 희망을 준 '코미나티' 외에도 2021년은 표적화하기 어려운 ‘undruggable’ 타깃으로 알려져왔던 KRAS 저해제 ‘루마크라스(Lumakras, sotorasib)’부터 최초의 알츠하이머 치료제로 허가받은 ‘아두헬름(Aduhelm, aducanumab)’까지, ‘세계 최초’라는 타이틀이 붙은 약물들이 FDA 승인을 받으며 업계의 눈길을 끌었다. 바이오스펙테이터는 지난 2021년 한 해를 되돌아보며 주목할 만한 FDA 승인신약을 주요 이슈별로 묶어 정리해봤다.
◆ 2021년 바이오∙신약 개발 업계를 달군 ‘최초’ - “KRAS”, “아두헬름” 그리고 “코로나19백신”
전체 61건의 FDA 승인 신약 중 지난 2021년을 대표할 수 있는 이슈로 ‘KRAS’, ‘아두헬름’ 그리고 ‘코로나19백신’을 꼽을 수 있다. 세 이슈의 공통점은 앞서 말했듯 FDA로부터 공식적으로 ‘최초’라는 타이틀을 받았다는 점이다.... <계속>



















