국제
녹십자 국내판권有 '허셉틴 바이오베터' 임상3상 순항
바이오스펙테이터 김성민 기자
마크로제닉스-녹십자 한국내 공동개발 및 판권보유 바이오베터 HER2 항체 '마르게툭시맙(margetuximab)'...임상3상 결과 2019년 도출, 위암환자 대상 PD-1 항체 병용투여 임상1상 진행중

녹십자가 한국 판권을 보유하고 있는 마크로제닉스의 바이오베터 HER2 항체인 '마르게툭시맙(margetuximab)'의 유방암 환자를 대상으로 한 SOPHIA 임상3상이 순조롭게 진행되고 있다(NCT02492711).
마크로제닉스는 최근 SOPHIA 임상3상에 대한 데이터안전성 모니터링위원회(data safety monitoring committee)의 분석결과, 안전성 이슈는 없었으며 임상 프로토콜에 변경없이 계속적으로 임상을 진행한다고 밝혔다. 단 1차 충족점인 무진행생존기간(PFS, progressive-free-survival)에서 조기 효능입증에 의한 임상 조기종료 조치는 없었다. 마크로제닉스에 따르면 올해 4분기에 환자모집이 마감될 것으로 예상되며, 2019년에 임상3상 결과가 나올 것으로 예상했다.
녹십자는 2010년 마크로제닉스와 한국내 공동개발 및 판권에 대한 계약을 체결한 바 있으며, 2011년 마크로제닉스에 23억원을 투자했다.
마르게툭시맙은 허셉틴(트라스투맙)과 HER2를 겨냥하지만, 항체의 Fc부분을 최적화를 통해 면역작용을 높인 형태의 단일클론항체(Fc-optimized monoclonal antibody)다. HER2는 유방암, 위암 등 다양한 고형암 환자에서 과발현하고 있다. 마크로제닉스는 이전 1~3차 치료요법을 받은 HER2+ 전이성 혹은 진행성 유방암 환자를 대상으로 임상3상, HER2+ 위암 환자를 대상으로 임상1상을 진행하고 있다.
유방암 환자를 대상으로하는 SOPHIA 임상3상은 마크게툭시맙+화학요법 혹은 트라스투맙+화학요법의 두개의 arm으로 구성되며, 글로벌 200개의 사이트에서 총 530명의 환자를 대상을 대상으로 진행하고 있다. 1차 충족점으로 PFS, 전체생존률(OS, overall survival)을 평가한다. 마크로제닉스는 미국 식품의약국(FDA)로부터 유방암 환자를 대상으로 마르게툭시맙의 신속심사(fast track) 지정을 받았다.
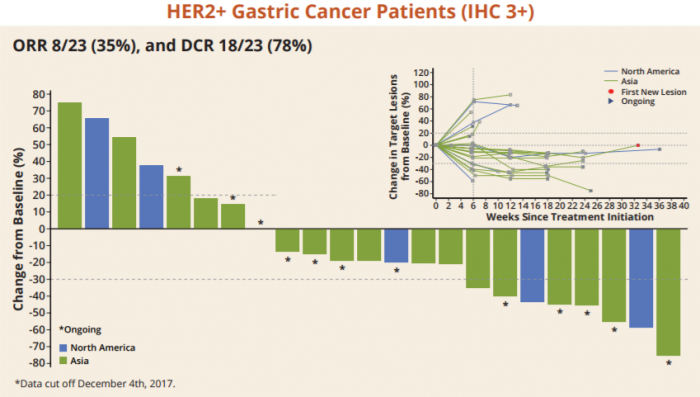
마크로제닉스는 그밖에 HER2+ 위암 환자를 대상으로 PD-1 항체와 병용투여 임상1b/2상을 진행하고 있다. 3차 치료제로 화학요법은 포함되지 않는 프로토콜(chemotherapy free- regiment)이다. 마크로제넥스가 올해초 열린 'ASCO GI(Gastrointestinal Cancers Symposium) 2018'에서 발표한 임상1b상 결과에 따르면 진행성 위암환자에서 마르게툭시맙과 PD-1 항체를 병용투여했을 때 ORR은 35%(8/23), DCR은 78%(18/23)로 나타났다. 아시아 위암환자에서 더 높은 반응율을 보였다는 것이 주목할 점이다.
▲2018 ASCO GI 포스터자료
한편, 허셉틴 바이오베터인 마르게툭시맙은 Fc 엔지니어링을 통해 ADCC(antibody dependent cellular cytotoxic) 등 Fc부분으로 매개되는 면역세포 세포독성작용(immune effector cell function)을 향상시켰다. Fc로 매개되는 면역작용은 Fc 수용체의 종류에 따라 활성화되거나 혹은 억제된다. 그런데 마크로제닉스는 Fc 엔지니어링을 통해 활성화 수용체인 FcγRIIIA(CD16A)에 대한 결합력을 높이고, 억제성 수용체인 FcRIIB(CD32B)에 대한 결합력을 낮춰 암세포에서 항체를 매개로한 세포독성작용을 높인 것. 또한 FcRγ allele-비의존성 디자인으로 환자가 지닌 CD16A 유전자형에 상관없이 활성을 가질 수 있게 조작했다는 설명이다. 그 필요성을 보여주는 예로 CD16A-F 유전자를 가진 환자에서 HER2 항체인 허셉틴의 ADCC 작용이 떨어진다.



















